ABSTRAK
Pemulihan adalah parameter kinerja utama dalam pemilah sel, metrik yang menilai kecocokan antara jumlah partikel yang dilaporkan telah disortir oleh instrumen dan jumlah partikel aktual yang dikumpulkan dalam wadah pengumpulan. Pemilahan bergantung pada waktu yang tepat dari pengisian tetesan yang berisi partikel yang diinginkan dalam pengukuran penting yang disebut drop delay (DD). Waktu DD biasanya bergantung pada reagen manik fluoresen yang direkomendasikan pabrikan. Pemilah sel berbasis kuvet khususnya bergantung pada manik QC berukuran tetap ini untuk pendekatan otomatis terhadap kalkulasi DD menggunakan sistem kamera berbasis gambar. Literatur sebelumnya telah menyoroti ketidakcocokan antara nilai DD ini dan pengaturan yang paling sesuai dengan sampel aktual. Di sini, kami menyajikan metode baru untuk kalkulasi DD—Metode Tiga Genangan (3PM), berdasarkan prosedur yang awalnya dijelaskan untuk pemilah sel jet-in-air ; metode ini mengoptimalkan nilai DD menurut partikel target yang akan disortir, meningkatkan pemulihan sortir untuk berbagai ukuran sel dan jenis partikel. Mengenai pemulihan, nilai DD yang dihitung 3PM berkorelasi dengan nilai yang dicapai melalui DD optimum, yang didefinisikan menggunakan protokol Rmax, metrik yang kuat untuk pemulihan. Keunggulan 3PM adalah protokol ini mudah diimplementasikan dan memiliki pengeluaran sel terbatas, yang penting dalam penanganan sampel langka yang berharga dan keberhasilan penyortiran sel tunggal dan massal serta aplikasi hilir yang bergantung padanya.
1 Pendahuluan
Salah satu perhatian utama para peneliti mengenai proses penyortiran sel adalah untuk memulihkan jumlah maksimum sel yang dipilih yang mungkin dari sampel aslinya. Pemulihan didefinisikan sebagai jumlah total partikel yang disortir dalam tabung koleksi, atas jumlah partikel target yang dilaporkan telah disortir oleh instrumen [ 1 ]. Pemulihan yang lebih rendah dapat disebabkan oleh sejumlah faktor, umumnya terkait dengan sampel, seperti viabilitas sel yang rendah, konsentrasi berlebih, atau sel yang lengket. Namun, dalam penelitian ini, kami menunjukkan bahwa pemulihan ditingkatkan dengan menyempurnakan DD instrumen, lebih khusus lagi dalam kaitannya dengan sel yang akan disortir.
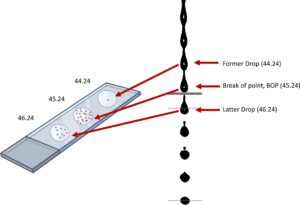
Penyortiran sel melibatkan pemisahan aliran fluida menjadi tetesan-tetesan individual. Muatan diberikan pada aliran ini, dan tetesan target, yang berisi sel yang diinginkan, dibelokkan menggunakan pelat tegangan tinggi ke bejana pengumpul. Pengisian aliran harus sesuai dengan waktu yang dibutuhkan partikel target untuk bergerak dari titik interogasi laser ke tetesan terakhir yang terpasang, yang juga dikenal sebagai titik putus (BOP) [ 2 ]. Pengukuran kritis ini disebut drop delay (DD) dan nilainya biasanya dihasilkan dengan menyortir manik-manik referensi pada berbagai waktu hingga pemulihan maksimum tercapai.
Instrumen sorter sel memiliki cara yang berbeda untuk memproses nilai DD ini. Dalam instrumen kuvet BD, nilai DD dihitung dengan memproses gambar kamera digital yang menunjukkan persentase manik-manik fluoresen yang disortir dan dibelokkan (manik-manik BD FACS Accudrop) dibandingkan dengan yang tidak dibelokkan. Hal ini bergantung pada akurasi gambar dan algoritma yang memperoleh hasil optimal dari berbagai nilai DD [ 3 ]. Sebaliknya, dalam instrumen jet-in-air , DD dapat dihitung dengan menyortir manik-manik fluoresen sebagai sejumlah tetesan yang membentuk genangan air, yang diendapkan pada slide standar, juga pada berbagai variasi DD [ 4 , 5 ]. Genangan air yang berisi sebagian besar manik-manik dalam berbagai genangan air ini dianggap oleh instrumen sebagai yang paling dekat dengan nilai DD optimal. Manik-manik terpencil yang disortir di kedua sisi genangan air ini kemudian dihitung dan dimasukkan kembali ke dalam wizard DD, yang kemudian akan menghasilkan nilai DD baru. Kami telah mengadaptasi metode genangan berbasis slide ini dari instrumen jet-in-air ke sistem sorter berbasis kuvet dan memodifikasinya untuk meningkatkan pemulihan sortasi. Prosedur ini membentuk dasar persamaan sederhana untuk metode kami, yang disebut Metode Tiga Genangan (3PM), di mana kami memeriksa dan menghitung partikel dalam tiga genangan dari setiap nilai DD yang relevan di bawah mikroskop dan, dalam prosesnya, menyempurnakan nilai DD.
Protokol yang diterbitkan sebelumnya yang disebut Rmax [ 6 ] digunakan untuk memeriksa keakuratan nilai DD instrumen otomatis dan memperbaiki masalah yang mendasarinya. Ini dilakukan dengan menyortir dari campuran dua populasi manik atau sel yang diberi label individual, di berbagai nilai DD, mengumpulkan aliran limbah yang berisi partikel-partikel yang tidak disortir oleh instrumen. Dengan merekam sampel yang dikumpulkan ini, berbagai persentase pemulihan dihitung untuk setiap nilai DD. Ini datang dengan biaya penggunaan manik-manik atau sel yang diinginkan untuk menghasilkan berbagai nilai yang cukup dan waktu yang dibutuhkan untuk memasukkan nilai optimum di dalamnya. Namun, dalam manuskrip ini, kami telah menggunakan Rmax untuk memvalidasi data 3PM dengan membandingkan pemulihan antara dua protokol di berbagai nilai DD yang digunakan untuk setiap partikel yang diuji.
Dalam studi ini, kami mengilustrasikan pentingnya ukuran yang sebelumnya diakui pada nilai DD [ 7 , 8 ] dengan menggunakan empat set manik-manik untuk 3PM, lebih kecil dan lebih besar dari manik-manik referensi standar, dan satu set manik-manik yang berukuran serupa dengan manik-manik referensi untuk memeriksa sensitivitas metode. Pemulihan dapat ditingkatkan dengan memilih partikel berukuran tepat untuk 3PM yang berhubungan dengan populasi target yang akan disortir dalam sampel. DD baru dapat dihitung menggunakan 3PM secara independen dengan manik-manik yang dipilih. Jelas, untuk memberikan ketahanan yang lebih besar pada metode ini, sel target sampel dapat digunakan jika tersedia sebagai pengganti manik-manik untuk melakukan 3PM dengan menggunakan protokol yang sama persis. Hanya beberapa ratus sel yang diperlukan untuk menghitung DD yang diperbarui menggunakan 3PM untuk meningkatkan pemulihan.
2 Bahan dan Metode
2.1 Teori di Balik Metode Tiga Genangan Air (3PM)
Berdasarkan manual dan perangkat lunak instrumen jet-in-air [ 4 , 5 ], kami membuat prosedur umum untuk menentukan DD secara manual untuk sorter berbasis kuvet. Prosedur umum untuk instrumen jet-in-air dinyatakan di sini dan dijelaskan sifatnya sebagai alur kerja.
- Dengan menggunakan Mode Sortir Tunggal, amplop 1 tetes (atau 1 tetes murni untuk Influx) dan manik kalibrasi fluoresensi, sejumlah genangan air diendapkan pada slide mikroskop. Beberapa panduan pengguna instrumen jet-in-air menetapkan jumlah ini menjadi 10, yang lain menjadi 3.
- Seratus tetesan disortir untuk membentuk masing-masing genangan air tersebut, masing-masing genangan air memiliki nilai DD yang berbeda; secara spesifik, genangan air akan berbeda dengan satu bilangan bulat dari nilai DD dan karenanya, jumlah manik-manik yang berbeda akan ada di dalam setiap tetesan.
- Berdasarkan probabilitas, penyebaran ke seluruh jumlah tetesan akan berupa 100 manik-manik, yang sebagian besarnya akan berada dalam satu genangan dan manik-manik sisanya berada di genangan yang berdekatan (kurang dari 50 manik-manik), jika fluida dan aliran kipas stabil.
- Genangan air diperiksa di bawah mikroskop fluoresensi, memperhatikan genangan air yang memiliki manik-manik terbanyak, lalu menghitung manik-manik pada tetesan terluar.
- Genangan air dengan butiran terbanyak menentukan bagian bilangan bulat dari DD. Jumlah butiran di genangan air yang berdekatan merupakan indikasi jumlah DD yang perlu diganti agar akurat hingga 1/100 tetes terdekat.
- Perubahan kemudian dilakukan pada nilai DD asli untuk mengakomodasi hal ini.
Berdasarkan mekanisme ini, yang dapat dilihat pada Gambar 1 , persamaan matematika sederhana dapat dikembangkan untuk menghitung nilai DD optimum:
![]()
DDnew (Nilai tetesan baru) adalah nilai DD yang dihasilkan dengan menerapkan persamaan, dan yang akan digunakan untuk melakukan pengurutan.
DDinitial (Nilai tetesan awal) adalah nilai yang awalnya disediakan oleh perhitungan otomatis instrumen, mengikuti spesifikasi pabrik dan berfungsi sebagai referensi. Dalam kasus instrumen BD berbasis kuvet, nilai ini disediakan oleh metode Accudrop otomatis.
Pembilang (selisih jumlah genangan yang dihitung) : mengikuti prosedur metode berbasis slide, manik-manik yang disortir ke genangan yang berdekatan dengan genangan yang memiliki manik-manik terbanyak dihitung di bawah mikroskop. Selisihnya dengan pengurangan jumlah manik-manik yang ditemukan di genangan dengan nilai yang lebih tinggi (genangan terakhir) terhadap genangan dengan nilai yang lebih rendah (genangan sebelumnya) dicatat.
Penyebut (jumlah manik-manik yang diurutkan) : selisih jumlah manik-manik yang tercatat di genangan air pada pembilang dibagi dengan jumlah total manik-manik yang diurutkan.
Penundaan Kenaikan : kami tetapkan pada angka 1, sebagai nilai default, yang berarti 1 penurunan utuh di atas dan di bawah nilai DD awal yang diestimasikan.
2.2 Pengaturan Instrumen
Sebelum menentukan DD secara manual, kami mengikuti langkah-langkah untuk memulai, menyelaraskan, dan menyiapkan instrumen seperti yang dijelaskan dalam Panduan Pengguna FACSAria Fusion [ 3 ]. Sorter BD FACS Aria Fusion (SN P656700000063) disiapkan dengan konfigurasi nosel 70 μm; tekanan 70 psi dan pembangkitan tetesan 89 kHz digunakan. BD FACS Diva CS&T Research Beads (REF:655051) digunakan selama penyiapan BD FACS Aria Fusion untuk menjalankan pemeriksaan kinerja instrumen, dan Partikel Kalibrasi Sphero Rainbow (8 puncak, CAT:559123) digunakan untuk memeriksa ulang penyelarasan optik instrumen yang memuaskan.
Prosedur penentuan DD otomatis dilakukan seperti yang dijelaskan dalam [ 3 ], menggunakan BD FACS Accudrop Beads (REF:345249, 6 μm) dan menetapkan keputusan sortir pada plot FSC-A versus SSC-A dengan wilayah sortir pada bagian plot yang kosong. Wilayah sortir dikonfigurasikan untuk memberikan keputusan sortir NOT; akibatnya, mengurutkan semua kejadian yang dipicu. Metode penentuan DD otomatis dilakukan dengan menggunakan presisi sortir Fine Tune (0-0-0), karena hanya satu drop yang akan disortir tanpa pembatalan, yang memungkinkan fluoresensi maksimum pada kamera dropir dikumpulkan dengan cara ini, seperti yang dijelaskan dalam [ 3 ]. Penundaan Drop Otomatis (AutoDD) ini dilakukan tiga kali untuk mengonfirmasi nilai DD ini sebagai referensi untuk eksperimen.
Untuk membersihkan instrumen setelah percobaan, larutan pembersih berbahan dasar deterjen seperti CoulterClenz (Beckman Coulter, kat. no. 8448222) atau 10% CONTRAD (Decon Labs, kat. no. 1002) dan air suling digunakan.
2.3 Metode Slide-Puddle yang Diadaptasi ke dalam Cuvette Sorter: Prosedur Metode Tiga-Puddle (3PM)
3PM adalah metode berbasis slide kalibrasi DD dan eksperimen berulang. Metode ini dapat dilakukan dengan manik berukuran apa pun yang mendekati ukuran sel target yang akan disortir, atau dengan sel itu sendiri.
Kaca objek standar yang bersih dan mikroskop cahaya terbalik yang dilengkapi dengan lensa 10x atau 20x sudah cukup untuk melakukan metode ini. Dalam kasus kami, kami menggunakan mikroskop terbalik Olympus IX-71 dengan lensa 10x dan 20x.
Prosedur 3PM beroperasi dengan cara berikut, secara default:
- Siapkan lembar kerja percobaan standar dengan plot dan gerbang yang relevan serta populasi target akhir. Ini harus mencakup plot FSC versus SSC, diskriminasi doublet, dan parameter fluoresensi.
- Atur perangkat instrumen Anda untuk tata letak sortir slide standar dan pilih mode sortir dengan kemurnian tinggi. Pada instrumen BD, 0-16-0 atau 0-32-0 lebih disukai.
- Pilih populasi target dalam tiga sumur terpisah dalam satu baris untuk menyimpan partikel dan atur jumlah yang akan disortir di setiap posisi menjadi 100.
- Lakukan pukul 3 sore:
- Tetapkan nilai DD dengan yang ditentukan oleh instrumen secara otomatis (DDinitial).
Pilah 100 partikel dalam tiga genangan dan periksa setiap genangan di bawah mikroskop.
Tidak perlu menghitungnya, cukup pastikan bahwa sebagian besar partikel tersortir dalam genangan. Dalam kasus melakukan 3PM dengan sel, langkah ini akan membantu pengenalan bentuk dan ukuran sel target yang akan dihitung nanti.
- Ubah nilai DD secara manual di jendela tata letak sortir menjadi satu satuan penuh di bawah nilai DD yang ditentukan oleh instrumen.
Pilah 100 partikel dalam masing-masing tiga genangan pada slide yang bersih dan tentukan jumlah partikel dalam setiap genangan di bawah mikroskop.
Hitunglah rata-rata partikel dalam ketiga genangan air ini, dan ini akan mencakup jumlah partikel dalam genangan air sebelumnya dalam persamaan.
- Tetapkan DD ke satu satuan penuh di atas DD awal dan ulangi proses di B. Hitung jumlah rata-rata partikel dalam tiga genangan ini dan ini akan mewakili jumlah partikel dalam genangan terakhir .
- Gunakan persamaan yang diperoleh dari penentuan DD secara manual pada sorter jet-in-air untuk menentukan nilai DD yang optimal. Peningkatan penundaan adalah satu unit (satu tetes penuh).

- Ubah nilai DD secara manual ke nilai hitung DDnew dan mulailah menyortir sampel. Jika diinginkan, langkah B dan C dapat diulang untuk meningkatkan jumlah iterasi, sehingga rata-rata akan lebih kuat. Diagram proses dapat dilihat pada Gambar 2 .

Bagan alir dari Metode Tiga Genangan (3PM). Langkah A : Sortir sampel yang terdiri dari 100 partikel untuk diperiksa dan catat ukuran dan bentuk partikel yang akan dikenali pada langkah berikutnya. Langkah B : Hitung partikel dengan penundaan jatuh yang diubah menjadi satu bilangan bulat kurang dari penundaan jatuh awal, dengan mengambil jumlah rata-rata dari tiga genangan yang disortir. Ini akan membentuk jumlah manik-manik dari genangan sebelumnya dalam persamaan. Langkah C : Ulangi proses ini setelah mengubah penundaan jatuh menjadi satu lebih banyak dari awal. Rata-rata menjadi angka dalam persamaan genangan terakhir . Langkah D : Hitung penundaan jatuh baru yang akan digunakan untuk penyortiran dengan menggunakan persamaan. Gambar mikroskopi diambil dalam mikroskop terbalik Olympus IX-71 dengan lensa 20x dengan Partikel Kalibrasi SPHERO AccuCount UltraRainbow yang disortir, 15 μm. [Gambar berwarna dapat dilihat di wileyonlinelibrary.com ]
Dengan 3PM, beberapa parameter dapat dimodifikasi: jumlah genangan, jumlah partikel yang disortir, dan penambahan penundaan. Berikut ini kami sampaikan pemikiran kami tentang bagaimana kami memilih parameter ini:
Jumlah genangan : Pada instrumen aliran udara BC , 10 genangan digunakan secara default karena metode berbasis slide digunakan sebagai pemindaian berbagai nilai DD. Namun, menurut Petunjuk Penggunaan MoFlo Astrios [ 4 ], manik-manik akan didistribusikan ke paling banyak tiga genangan jika fluida dan aliran kipas stabil. Untuk menyempurnakan nilai DD, hanya diperlukan tiga genangan: genangan dengan manik-manik terbanyak (diatur oleh nilai tetesan awal) dan genangan yang berdekatan (terakhir dan sebelumnya).
Jumlah partikel yang disortir : Menambah jumlah partikel yang disortir ke orde besaran akan menghasilkan nilai DD dengan lebih banyak tempat desimal, misalnya, mengurutkan 1000 partikel dan menghitung partikel di kedua sisi akan menghasilkan nilai DD dengan tiga tempat desimal, presisi yang tidak digunakan oleh sebagian besar penyortir kuvet sel. Selain itu, menghitung sebagian dari 1000 kejadian dalam genangan air dapat menjadi pekerjaan yang membosankan, tidak akurat, dan memakan waktu.
Demikian pula, mengurangi orde besaran jumlah partikel yang dipisahkan menjadi 10 akan menghasilkan nilai DD numerik dengan satu desimal, sehingga mengurangi kapasitas presisi instrumen, yang mampu membedakan dua desimal dalam nilai DD. Selain itu, genangan air yang lebih kecil yang terbentuk dari pemilahan 10 partikel mengering dengan cepat.
Kami memilih menggunakan 100 partikel untuk disortir sebagai default, karena menghasilkan jumlah partikel yang dapat dihitung secara wajar dalam jangka waktu tertentu sambil menghindari genangan air mengering.
Peningkatan penundaan : yang digunakan secara default adalah satu unit, yaitu satu tetes penuh di atas dan di bawah nilai DD awal yang diperkirakan. Alasannya adalah jumlah manik-manik yang dihitung dalam tetes-tetes yang berdekatan dipengaruhi oleh variasi nilai ini. Peningkatan penundaan yang lebih rendah berarti lebih banyak manik-manik akan disortir dalam genangan, sehingga meningkatkan kesalahan penghitungan karena jumlah manik-manik yang diendapkan pada slide lebih banyak. Menetapkan nilai peningkatan penundaan terlalu tinggi berarti terlalu sedikit manik-manik yang diendapkan, sehingga mengurangi sensitivitas metode. Nilai default 1 memastikan ada jumlah penghitungan yang wajar menurut pengamatan tetapi juga bahwa akurasi penyortiran berada dalam batas yang dapat diterima.
2.4 Validasi 3PM Dengan Rmax Menggunakan Beads
Untuk memvalidasi metode kami, 3PM dibandingkan dengan protokol Rmax dengan mengukur pemulihan sort [ 6 ]. Penelitian sebelumnya juga menunjukkan bahwa partikel dengan ukuran berbeda, dalam kaitannya dengan manik referensi, memengaruhi akurasi DD dan ini menghasilkan pemulihan yang kurang optimal [ 8 , 9 ], sehingga eksperimen validasi dilakukan dengan menggunakan berbagai ukuran manik, dijelaskan di bawah ini, agar metode kami relevan untuk berbagai ukuran sampel khas dan untuk menetapkan data kinerja pemulihan sort.
Manik-manik yang digunakan untuk pengujian adalah sebagai berikut:
- Kit BD Calibrite 2-Warna (REF: 349502).
- Partikel Fluoresensi SPHERO UltraRainbow 10 7 /mL, 1,0–1,4 μm, 5 mL (REF: URFP-10-5).
- Partikel Fluoresensi SPHERO UltraRainbow 10 7 /mL, 3,0–3,4 μm, 2 mL (REF: URFP-30-2).
- Partikel Kalibrasi SPHERO AccuCount UltraRainbow, 7,0 μm (±1 μm), 5 × 10 7 /mL, 1 mL (REF: ACURFP50-70-1).
- Partikel Kalibrasi SPHERO AccuCount UltraRainbow, 10,0 μm (±1 μm), 2 × 10 7 /mL, 1 mL (REF: ACURFP20-100-1).
- Partikel Kalibrasi SPHERO AccuCount UltraRainbow, 15,0 μm (±2 μm), 5 × 10 6 /mL, 1 mL (REF: ACURFP5-150-1).
- Coulter CC Ukuran Standar L20 (REF: 6602798).
Percobaan dilakukan dengan menggunakan presisi sortir yang ketat (0-32-0); dengan cara ini, versi sederhana dari persamaan Rmax [ 6 ] dapat digunakan jika kemurnian mendekati 100% dan oleh karena itu fraksi yang disortir tidak perlu diperoleh. Persamaan ini adalah sebagai berikut:
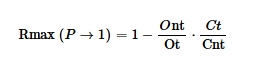
Untuk validasi Rmax, diperlukan dua populasi berlabel untuk populasi target dan non-target. Populasi target ( t ), yang terdiri dari semua partikel dalam sort gate, dan populasi non-target ( nt ), yang terdiri dari partikel terpicu yang tersisa. “ O ” menunjukkan sampel asli dan “ C ” menunjukkan sampel aliran tengah.
Untuk menghindari penggunaan bahan yang berbeda atau perbedaan dalam pembuatan, semua manik-manik yang digunakan untuk membentuk campuran sampel berasal dari perusahaan yang sama. Semua manik-manik terbuat dari polistirena dan, untuk meminimalkan kemungkinan bias karena bahan dan indeks refraksi partikel, kami harus berkompromi dengan menggunakan manik-manik dengan ukuran yang sedikit berbeda, bukan fluoresensi yang berbeda, karena rentang ukuran yang disediakan oleh perusahaan tidak berada dalam saluran fluoresensi yang kami perlukan. Dalam percobaan kami, partikel terbesar dari keduanya dalam campuran dipilih sebagai partikel target sehingga ukuran manik-manik yang lebih kecil tidak mengganggu pengukuran Rmax. Manik-manik ini dan manik-manik referensi dikutip dengan toleransi rentang ukuran seperti yang dapat dilihat di atas dalam uraian, yang secara logis dapat menyebabkan variabilitas kecil dalam nilai pemulihan.
Setiap sampel yang mengandung dua kombinasi manik diencerkan dalam PBS 0,1% BSA untuk membuat dua populasi berlabel dengan sekitar 50% dari masing-masing dan disonikasi selama 1 menit dalam pembersih ultrasonik (ULTR-0L8-001, Frekuensi 40KHz) sebelum akuisisi. Plot FSC-A versus SSC-A, FSC-H versus FSC-A dan FITC-A versus PE-A digunakan untuk menentukan wilayah sortir ( Informasi Pendukung ). Tegangan dan ambang batas disesuaikan untuk mendapatkan visualisasi optimum dari partikel yang berbeda. Eksperimen Rmax kemudian dilakukan dengan melakukan Protokol “Menemukan Rmax maksimum” [ 10 ] dengan jenis manik yang sama, eksperimen dan presisi mode sortir yang digunakan untuk melakukan 3PM.
Selama penyortiran, efisiensi ditetapkan pada 99%–100% dan partikel aliran tengah dikumpulkan. Sekitar 5 mL per tabung (tiga kali lipat setiap kondisi) tangkapan aliran tengah (CSC) dikumpulkan, dengan hati-hati menghindari aliran penyortiran, yang ditetapkan pada defleksi paling kanan 100%. Partikel yang disortir tidak dikumpulkan, karena nilai kemurnian tidak relevan dengan penelitian kami.
Sebelum analisis sampel tangkapan, tabung CSC disentrifugasi untuk menghemat waktu proses. Partikel aliran limbah dan sampel pra-sortir asli dianalisis pada sitometer BC CytoFlex S (SN BE05013). Jumlah dan frekuensi kejadian target dan non-target dalam fraksi yang berbeda dicatat untuk perhitungan Rmax, dengan mempertimbangkan 400 kejadian di gerbang target sebagai jumlah yang cukup, dan file fcs dianalisis menggunakan FlowJo 10.6.2 untuk Sistem Operasi Mac OS X.
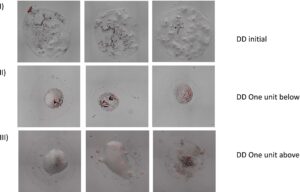
Pada Gambar 3 , contoh bagaimana genangan manik-manik fluoresensi terlihat di bawah mikroskop.

Kami menggunakan lini sel dengan morfologi yang berbeda untuk lebih memvalidasi protokol di luar keseragaman ukuran dan bentuk manik-manik. Sel dikultur dalam labu T-75 cm 2 dengan medium kultur sel RPMI 1640 yang dilengkapi dengan 10% FBS dan 1% Penisilin dan Streptomisin pada suhu 37°C dalam inkubator CO 2 5% . Jumlah sel yang sama (biasanya masing-masing 10 juta) dicuci dua kali lalu diencerkan dalam dua tabung berbeda dengan PBS 2% BSA dan dengan Cell Tracker Green (Invitrogen C2925 1 mg) atau Orange (Invitrogen C2927 1 mg) pada konsentrasi akhir 1 μM dan diinkubasi selama setengah jam pada suhu 37°C. Setelah inkubasi, sel dicuci lagi dan diinkubasi dengan DAPI (pengenceran 1:1000 dari 1 mg/mL) untuk memperoleh populasi hidup yang berlabel dengan 50% dari masing-masing, yang dicampur dengan hati-hati sebelum akuisisi.
Plot DAPI-A versus FSC-A, FSC-A versus SSC-A, FSC-H versus FSC-A, SSC-W versus FSC-A, dan FITC-A versus PE-A digunakan untuk menentukan wilayah sortir ( Informasi Pendukung ). Voltase dan ambang batas disesuaikan untuk memperoleh visualisasi optimum dari dua populasi sel. Eksperimen Rmax kemudian dilakukan dengan mengikuti Protokol “Mengevaluasi pengaturan Sorter dengan Rmax ” tetapi dengan mempertimbangkan semua rekomendasi yang diberikan dalam “Protokol Alternatif: Menemukan Rmax maksimum untuk sel” [ 10 ]. Kali ini, rangkap tiga CSC dikumpulkan untuk nilai DD Otomatis dan untuk nilai DD 3PM yang diperoleh dengan menggunakan metode kami. Perangkat lunak BD FACSDiva V 8.0 (2013) digunakan untuk mengendalikan instrumen dan file fcs dianalisis menggunakan FlowJo 10.6.2 untuk Sistem Operasi Mac OS X.
Gambar 4 menunjukkan genangan sel yang diperiksa di bawah mikroskop. Gambar tambahan dapat dilihat di Informasi Pendukung .
Uji statistik dilakukan di GraphPad Prism 9.0.1 untuk macOS. Variabel kuantitatif dijelaskan dengan rata-rata, simpangan baku, dan persentase. Perbandingan variabel kuantitatif dilakukan menggunakan analisis ANOVA satu arah atau uji t Student dalam kasus dua kelompok set data. Korelasi antara parameter numerik dianalisis dengan menghitung koefisien korelasi Spearman’s rho.
Untuk semua pengujian, signifikansi statistik ditetapkan pada p ≤ 0,05.
3 Hasil
3.1 Menetapkan Pemulihan Optimal Menggunakan Kurva Rmax
Pertama-tama kami ingin membangun keyakinan dalam mode presisi sortir pilihan kami yaitu 0-32-0 dibandingkan dengan yang digunakan oleh metode Rmax, yang untuk instrumen BD adalah presisi sortir 0-16-0. Nilai kemurnian 32 yang lebih tinggi lebih memaksimalkan kejadian kebetulan dibandingkan dengan nilai kemurnian 16 dan dengan demikian meningkatkan jumlah pembatalan yang akan dikumpulkan dalam CSC. Kami mengumpulkan data pemulihan menggunakan tiga mode presisi sortir yang berbeda untuk menunjukkan bahwa DD optimal pada rentang nilai dihasilkan oleh 0-32-0 dibandingkan dengan mode presisi sortir lainnya (Gambar 5A ).
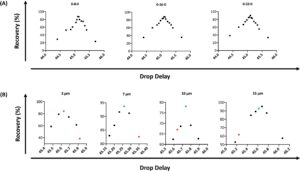
Bahasa Indonesia: Setelah menetapkan mode sortir 0-32-0, kami menjalankan serangkaian eksperimen Rmax untuk setiap ukuran manik yang ingin kami gunakan dalam studi kami. Ini untuk memeriksa bahwa masing-masing menghasilkan kurva yang cukup simetris dari titik data yang dikumpulkan dari mana nilai Rmax DD optimum dapat diamati sebagai puncak tertinggi (Gambar 5B ). Untuk setiap ukuran manik, kami juga menetapkan persentase pemulihan DD otomatis menggunakan manik Accudrop (titik merah), dibandingkan dengan yang menggunakan 3PM (titik hijau), di mana dapat diamati bahwa ada perbedaan yang jelas dalam nilai pemulihan. Dalam hal sensitivitas metode, penting untuk menggunakan rentang titik pengumpulan data yang lebih sempit dengan beberapa eksperimen Rmax. Ini memungkinkan kami untuk mengamati dengan jelas perbedaan persentase pemulihan antara dua manik berukuran sama, seperti yang terjadi dengan manik Accudrop (sekitar 6 μm) dan manik 7 μm yang diuji. Ukuran manik yang lebih besar menghasilkan perbedaan yang lebih lebar dalam nilai pemulihan, jadi kami menyesuaikan nilai pengumpulan Rmax DD kami dan, dengan cara ini, menghasilkan rentang kurva Rmax yang memuaskan untuk setiap ukuran manik.
3.2 Perbandingan Pemulihan Metode Tiga-Puddle dengan Nilai Rmax dan DD Otomatis dengan Menggunakan Beads
Kisaran nilai DD berdasarkan persentase pemulihan terbaik untuk semua jenis manik yang diperoleh menggunakan Rmax dan 3PM diplot pada Gambar 6. Hal ini dilakukan untuk mengonfirmasi korelasi kuat antara hasil kedua metode ini dan dengan demikian memvalidasi metode 3PM dengan menggunakan metode Rmax.
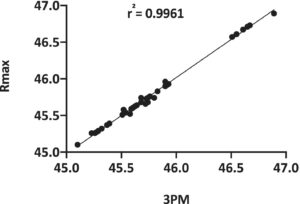
Kami membandingkan semua pemulihan menggunakan protokol DD Otomatis, DD 3PM, dan DD Rmax. Nilai DD otomatis diperoleh dengan mengikuti petunjuk pabrik dan nilai DD 3PM dengan mengikuti proses yang dijelaskan dalam Bagian “Prosedur Metode Tiga-puddle (3PM)”. Hasil Otomatis dan 3PM juga dikumpulkan dalam rangkap tiga seperti yang dijelaskan dalam bagian “Validasi 3PM dengan Rmax menggunakan manik-manik”. Dalam semua kasus, pemulihan dengan metode 3PM secara signifikan lebih tinggi daripada dengan metode otomatis (Gambar 7A,B ). Pemulihan maksimum kemudian dihitung menggunakan metode Rmax, dengan pemulihan berkorelasi tinggi dengan 3PM, yang memvalidasi, oleh karena itu, kenyamanan menggunakan 3PM sebagai peningkatan atas sistem berbasis gambar dan juga protokol Rmax dalam menghitung DD untuk pekerjaan penyortiran harian.

Data kami (Gambar 7A ) menunjukkan bahwa, dalam hal pemulihan, nilai pemulihan DD Otomatis (Otomatis) secara konsisten lebih rendah daripada nilai DD 3PM atau DD Rmax, yang menunjukkan peningkatan yang jelas menggunakan metode kami. Selain itu, nilai 3PM dan Rmax tidak memiliki perbedaan yang signifikan dalam hal pemulihan untuk hampir setiap jenis manik yang digunakan, yang memverifikasi bahwa data yang diberikan oleh 3PM berkorelasi secara konsisten dengan nilai DD dengan persentase Rmax yang optimal. Dalam gambar ini, eksperimen manik 3 μm tidak menunjukkan perbedaan sama sekali antara 3PM dan Rmax, dan perbedaan yang ditemukan saat menyortir 7 dan 10 μm tidak signifikan ( p > 0,05).
Satu-satunya anomali signifikan mengenai Rmax dari 3PM ditemukan ketika menyortir manik-manik 15 μm, yang kami spekulasikan disebabkan oleh ukuran partikel ini dalam kaitannya dengan penggunaan nosel 70 μm. Diketahui bahwa ukuran partikel target harus 5 kali lebih kecil dari lubang nosel [ 1 ], dan meskipun kami memiliki pemulihan sesuai dengan harapan, dengan menggunakan manik-manik ini, kami menguji kondisi eksperimen dalam kemungkinan skenario terburuk “dunia nyata”. Pengisian tetesan yang tidak akurat dapat menyebabkan beberapa penyemprotan aliran sortir saat menyimpan genangan air ke slide, oleh karena itu beberapa kesalahan penghitungan kejadian mungkin terjadi saat menetapkan 3PM. Meskipun ada keterbatasan ini, pemulihan masih ditingkatkan saat menggunakan nilai DD 3PM atau Rmax.
Dalam hal perbedaan ukuran dari manik referensi (Gambar 7B ), kami menemukan jumlah perbaikan paling sedikit dengan manik 10 μm sebagai partikel target (8,41%) dan, yang mengejutkan, perbaikan lebih tinggi dengan 7 μm (20,68%), mengingat ini adalah manik berukuran paling mirip dengan kontrol referensi (manik Accudrop, 6 μm). 3PM menunjukkan peningkatan dalam pemulihan saat menyortir partikel 3 μm sebesar 29,06%, dan peningkatan rata-rata 15,67% saat menyortir 15 μm, membuat kami berpikir bahwa bukan hanya partikel yang lebih besar yang dapat menjadi masalah dalam hal pemulihan, tetapi juga partikel yang lebih kecil. Peningkatan dengan partikel 3 μm adalah dua kali lipat dari yang 15 μm, jadi ini harus menjadi sesuatu yang perlu dipertimbangkan saat menyortir partikel yang lebih kecil daripada yang referensi.
3.3 Penerjemahan Metode ke Lembaga Lain
Setelah 3PM divalidasi dengan manik-manik menggunakan Rmax, kami memeriksa apakah hasil kami dapat direproduksi dalam instrumen kuvet lain di lembaga lain. Perbandingan antara pemulihan menggunakan perhitungan otomatis terhadap 3PM dilakukan pada pemilah sel lain (Gambar 7C ).
Pada sorter BD, kuvet persegi panjang dan persegi diketahui berperilaku berbeda [ 7 , 8 ], sehingga semua eksperimen yang dilakukan pada instrumen BD dilakukan pada sorter sel kuvet persegi. Pada Informasi Pendukung , gambar dan nomor seri instrumen yang digunakan ditampilkan.
Kami mengamati peningkatan perolehan yang sama dengan menggunakan 3PM pada sorter kuvet persegi lainnya (Gambar 7C ). Perbedaan perolehan, “antar-instrumen” dapat terjadi karena berbagai alasan, tetapi alasan utamanya adalah fakta bahwa eksperimen di lab lain dilakukan pada hari yang sama, sementara eksperimen yang dilakukan di lab kami (IBiS) dilakukan pada hari yang berbeda, dengan campuran manik-manik, pengaturan, dan sebagainya yang berbeda. Meskipun demikian, kecenderungannya sama, dan peningkatan diamati.
3.4 Perbandingan Pemulihan Sel Antara Nilai DD Otomatis dan 3PM
Untuk menyimpulkan tujuan akhir dari pekerjaan ini, yaitu untuk menciptakan metode yang cepat dan mudah untuk meningkatkan pemulihan dalam sampel nyata, kami menguji 3PM menggunakan sel sebagai pengganti manik-manik. Membuat kurva Rmax dari nilai DD dapat menjadi pemborosan sebagai prosedur harian dengan sel nyata karena jumlah sel yang dibutuhkan untuk membentuk rentang nilai DD yang sesuai, jadi, dalam kasus ini, kami menerapkan validasi dengan Rmax hanya dalam penentuan DD Auto dan 3PM. Dalam penelitian ini, kami membandingkan berbagai lini sel suspensi atau adhesif: Jurkat, THP1, A549, H1650, H1781, dan H2009.
Data kami menunjukkan bahwa nilai Auto dan 3PM memiliki perbedaan signifikan ( p < 0,05) dalam hal pemulihan untuk semua berbagai lini sel yang diuji, menunjukkan peningkatan pemulihan dengan membandingkan nilai DD Automated dengan nilai DD 3PM (Gambar 8A ).

Rata-rata pemulihan yang terlihat pada Gambar 8B untuk sel-sel yang melekat bervariasi dari 9,05% dari H2009 hingga 17,17% dari H1650. Peningkatan pemulihan untuk sel-sel suspensi (garis sel Jurkat dan THP1) lebih tinggi (masing-masing 13,45% dan 23,61%) dan deviasi standar lebih ketat daripada yang melekat. Kami berspekulasi ini sebagian dapat disebabkan oleh ketidakhomogenan dan kelengketan sel-sel yang melekat ini dan efeknya pada aliran dan laju aliran. Mengenai sel-sel suspensi, peningkatan pemulihan THP1 jauh lebih tinggi dibandingkan dengan sel-sel Jurkat. THP1 adalah garis sel yang berasal dari monosit, yang lebih besar dari Jurkat (garis sel yang berasal dari limfosit) sehingga sel-sel Jurkat lebih mirip ukurannya dengan manik-manik referensi, itulah sebabnya kami mengharapkan lebih sedikit peningkatan daripada saat menggunakan THP1.
3.5 Pertimbangan Mengenai Ukuran Nosel
Penelitian lain tentang eksperimen sort recovery telah menggunakan konfigurasi yang berbeda seperti nosel 100 μm [ 9 ]. Penggunaan BD FACS Aria Fusion dengan nosel 70 μm menggambarkan efektivitas metode kami lebih jelas daripada menggunakan ukuran nosel yang lebih besar untuk sort recovery. Keputusan kami untuk menyertakan manik-manik dan sel yang relatif besar menguji metode kami sehubungan dengan skenario terburuk dalam hal rasio ukuran nosel terhadap sel, karena diketahui bahwa hasil sortasi sel semakin sensitif terhadap ukuran diameter nosel yang lebih kecil [ 11 ].
Dalam menerapkan 3PM saat menggunakan ukuran nosel yang berbeda, kami menggunakan manik Coulter CC Size Standard 20 μm dan menemukan bahwa perbedaan nilai DD yang menghasilkan pemulihan optimal, seperti yang diharapkan, sangat tinggi saat menggunakan konfigurasi 70 μm (memiliki rata-rata perbedaan 0,86) tetapi kurang jelas dengan konfigurasi 85 dan 100 μm (Gambar 9 ). Penyortiran data partikel 20 μm ini menggunakan ukuran nosel yang lebih besar menunjukkan bahwa nilai DD bervariasi sekitar sepertiga dari nilai DD otomatis (rata-rata perbedaan 0,30 untuk nosel 85 μm dan 0,36 untuk 100 μm), yang mengarahkan kami untuk menyimpulkan bahwa pemulihan sortir akan ditingkatkan menggunakan 3PM dengan ukuran nosel yang lebih besar juga.
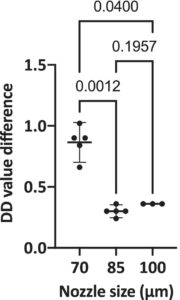
Terakhir, partikel dengan ukuran berbeda secara konsisten menghasilkan nilai DD yang berbeda secara korelatif dalam pemilah kuvet ( Informasi Pendukung ). Partikel yang lebih besar, bahkan dalam rasio ukuran nosel terhadap partikel yang direkomendasikan, dapat memiliki perbedaan lebih dari setengah dari keseluruhan tetesan sebagai nilai DD terhadap nilai otomatis. Dalam kasus ini, disarankan untuk mengubah ukuran nosel ke yang lebih besar.
4 Diskusi
Dalam studi ini, kami menemukan bahwa 3PM berhasil dalam sortasi dengan manik-manik yang relatif seragam di mana pemulihan sortasi memiliki tren di atas 80%. Saat menyortir lini sel suspensi menggunakan pewarna viabilitas, kami mencatat peningkatan pemulihan hingga 23% dibandingkan nilai DD otomatis. Dengan lini sel yang kurang homogen dan melekat, cenderung lebih tidak teratur dalam ukuran, bentuk, dan kelengketan, kami mencatat peningkatan pemulihan hingga 17%. Variasi ini konsisten dengan data yang dipublikasikan dalam Protokol “Evaluasi Pemulihan Sortasi dengan Rmax” [ 10 ].
Metode kami mengatasi sejumlah masalah penyortiran sitometri saat ini. Instrumen kuvet BD bergantung pada keakuratan gambar BOP yang diproses, yang memiliki masalah dengan gambar yang tidak terdeteksi sesekali dan saturasi kamera yang tinggi. Hal ini menyebabkan rentang nilai yang lebih besar dari yang dibutuhkan dihasilkan untuk nilai DD, yang menghabiskan waktu dan manik-manik. Perlu disebutkan bahwa Partikel Kalibrasi SPHERO AccuCount UltraRainbow telah dirancang untuk memeriksa ulang kalibrasi otomatis ini dengan ukuran yang berbeda, yang, setelah pengujian, kami temukan menyebabkan lebih banyak masalah yang sama ini. Metode Rmax, yang dapat efektif dalam memerangi masalah ini dengan menentukan nilai DD yang optimal, juga memakan waktu, sel, dan reagen untuk dilakukan setiap hari.
Oleh karena itu, ada sejumlah keuntungan saat menggunakan metode 3PM:
Mudah digunakan dan cepat , hanya memerlukan penyortiran beberapa genangan air dan penghitungan sejumlah kecil partikel di bawah mikroskop. Metode ini hanya menggunakan sedikit sampel, yang menguntungkan ketika sampel yang berharga dan populasi langka harus disortir.
Fleksibel karena dapat mengoreksi nilai DD apa pun selama hari penyortiran. Misalnya, pemeriksaan ulang DD setelah aliran berubah secara fisik karena penyumbatan nosel atau perubahan suhu dan tekanan yang dapat memengaruhi efisiensi penyortiran di siang hari .
3PM juga menghilangkan masalah keamanan hayati selama pengujian sel. Protokol Rmax mengharuskan pengumpulan sampel aliran limbah selama pemilahan, di dalam ruang pemilahan instrumen, dalam jangka waktu yang lama. Operator dapat terpapar risiko biologis yang tidak perlu saat mengumpulkan berbagai sampel Rmax. Penggunaan 3PM hanya memerlukan waktu beberapa menit, dan satu-satunya kontak potensial dengan sel adalah melalui slide mikroskop.
Selain itu, 3PM relatif murah , karena hanya memerlukan sedikit manik atau sel. Selain itu, karena 3PM akan mengoreksi nilai DD apa pun, setelah rentang nilai DD yang umum dari penyortiran harian ditetapkan (dengan ketentuan bahwa ada pengaturan yang stabil untuk instrumen tersebut—BOP, ukuran nosel, tekanan, dll.), langkah menjalankan manik referensi untuk kalibrasi DD secara otomatis dapat dihilangkan.
Namun keuntungan utama dari 3PM adalah bahwa pemulihan sortasi lebih tinggi dibandingkan dengan menggunakan DD otomatis. Dengan menggunakan Rmax sebagai pemeriksaan pemulihan, kami telah mengamati peningkatan rentang pemulihan ~10%–30% menggunakan manik-manik berukuran berbeda (Gambar 7B ) dan pemulihan ~10%–25% menggunakan lini sel yang berbeda (Gambar 8B ).
4.1 Keterbatasan Metode
3PM idealnya memerlukan mikroskop fluoresensi yang terletak dekat dengan sorter untuk menghitung manik-manik atau sel dengan cepat sebelum genangan mengering. Pada Gambar 3 dan 4 , tiga genangan dari setiap DD yang diperlukan diperlihatkan, dengan manik-manik dan dengan sel. Dapat diperhatikan bahwa genangan mengering dengan cepat, yang terkadang dapat menyebabkan kesalahan penghitungan partikel, jadi semakin dekat mikroskop dengan sorter, semakin baik untuk metode tersebut. Fluoresensi membantu memvisualisasikan partikel di setiap genangan dan juga genangan satelit kecil yang dibuat di luar genangan utama jika penyemprotan terjadi (biasanya dengan manik-manik yang lebih besar). Namun, bahkan jika genangan mengering, kami mengalami dengan mikroskop kami bahwa partikel sekecil 3 μm dapat dihitung bahkan dengan fluoresensi yang relatif rendah.
Tentu saja, partikel yang lebih kecil, seperti mikrovesikel, dapat sulit dideteksi dengan lensa objektif mikroskop standar seperti yang digunakan dalam penelitian ini. Dalam kasus ini, perkiraan dapat dibuat dengan menggunakan manik-manik fluoresen terang berukuran serupa dan mencatat bahwa bahkan nilai DD perkiraan berdasarkan 3PM akan lebih disukai daripada menggunakan DD yang dihasilkan secara otomatis. Ini juga merupakan pertimbangan untuk sel-sel yang mungkin tidak memiliki kecerahan fluoresen yang cukup untuk divisualisasikan, dan dalam kasus ini pemeriksaan di bawah mikroskop harus cepat.
Mengenai kesalahan penghitungan, 3PM terdiri dari pembuatan genangan air untuk metode berbasis slide dalam rangkap tiga untuk setiap nilai DD yang dibutuhkan (maka dari itu nama metode tersebut), tetapi tentu saja lebih banyak genangan air dapat disortir untuk keyakinan yang lebih besar akan keakuratan penghitungan. Untuk data dalam penelitian ini, kami membuat 3 dari setiap slide ini, yang menghasilkan hitungan yang konsisten, mengurangi kemungkinan bias pengukuran observasional ( Informasi Pendukung ).
Pengecualian untuk 3PM terjadi jika diperlukan untuk menyortir lebih dari satu populasi dengan ukuran yang berbeda, misalnya, limfosit dan monosit. Rekomendasinya adalah menggunakan nosel yang lebih besar, dalam hal ini nilai DDnew 3PM akan memiliki efek yang lebih kecil pada pemulihan berdasarkan Gambar 9 .
5. Kesimpulan
Data kami menunjukkan bahwa nilai yang diperoleh menggunakan 3PM berkorelasi baik dengan hasil Rmax untuk setiap jenis manik yang digunakan, dan oleh karena itu kami dapat yakin bahwa metode kami divalidasi oleh Rmax. 3PM cepat dan andal serta menghasilkan nilai DD yang pemulihannya selalu ditingkatkan dengan menggunakannya, tidak peduli ukuran partikel atau sel . Ini adalah cara untuk meningkatkan sistem kalibrasi DD otomatis, yang kami temukan memakan waktu dan kurang akurat berkenaan dengan nilai DD dalam kaitannya dengan pemulihan, dan juga mahal dalam hal pembelian manik. 3PM juga spesifik untuk sel yang akan disortir, secara akurat mencocokkan nilai DD yang sesuai dan meningkatkan pemulihan sebagai hasilnya.
Percobaan di masa mendatang dapat menguji sorter tambahan untuk akurasi DD otomatis versus 3PM, dengan bantuan dari komunitas flow cytometry.