ABSTRAK
Alasan
Uji coba terkontrol acak dianggap sebagai ‘standar emas’ dalam penelitian klinis dan pengambilan keputusan. Akan tetapi, banyak uji coba memiliki kelemahan signifikan yang gagal diidentifikasi oleh proses peninjauan saat ini cukup dini untuk dilakukan perbaikan. Kelemahan dalam desain, pelaksanaan, dan pelaporan uji coba pada akhirnya menyebabkan pemborosan penelitian. Peninjauan cepat ini memberikan wawasan dari penelitian global yang bertujuan untuk meningkatkan ‘informatifitas’ uji coba seperti yang dijelaskan oleh Zarin dan rekan-rekannya.
Metode
Tinjauan cepat dilakukan dengan fokus pada penelitian yang membahas proses desain uji coba yang dapat meningkatkan keinformatifan yang selaras dengan satu atau lebih dari lima kondisi utama yang diuraikan oleh Zarin dan rekan-rekannya: 1) Pentingnya, 2) Desain, 3) Kelayakan, 4) Integritas dan 5) Pelaporan. Analisis tematik lebih lanjut dilakukan menggunakan NVivo 12.
Hasil
Tinjauan akhir mencakup 42 teks. Dari 27 proses atau tindakan yang direkomendasikan untuk meningkatkan keinformatifan uji klinis, sebagian besar relevan dengan kondisi kedua desain uji klinis (2) Desain; 44%). Rekomendasi utama adalah penggunaan ‘alat’ untuk meningkatkan keinformatifan uji klinis. Sebanyak 23 alat diidentifikasi di seluruh kondisi 1) Pentingnya (17%), 2) Desain (74%) dan 5) Pelaporan (9%).
Kesimpulan
Tinjauan ini menyoroti bagaimana pemahaman yang lebih baik tentang proses desain yang mengarah pada uji coba informatif dapat mengurangi atau menghilangkan pemborosan penelitian. Penelitian lebih lanjut diperlukan tentang bagaimana proses ini dapat mendukung tinjauan sejawat prapendanaan dengan lebih baik, yang juga akan meningkatkan kemungkinan menghasilkan uji coba informatif.
1 Pendahuluan
Uji coba terkontrol acak (RCT) dianggap sebagai ‘standar emas’ dalam penelitian dan pengambilan keputusan, khususnya dalam perawatan kesehatan, ilmu sosial, dan intervensi kebijakan. Namun, banyak uji coba memiliki kelemahan signifikan yang tidak dapat diidentifikasi oleh proses peninjauan saat ini cukup awal untuk melakukan perbaikan. Kelemahan dalam desain, pelaksanaan, dan pelaporan uji coba menyebabkan pemborosan penelitian karena tidak memajukan pengetahuan ilmiah dan tidak memberikan hasil nyata atas sumber daya yang diinvestasikan selama proses uji coba [ 1 – 3 ].
Pandemi COVID-19 menyoroti masalah pemborosan penelitian dan uji klinis yang tidak memberikan informasi bermanfaat untuk pengambilan keputusan klinis [ 4 ]. Sebuah studi tahun 2020 menemukan bahwa 42% uji klinis COVID-19 yang dilakukan di Eropa Barat dirancang dengan buruk dan berkontribusi terhadap pemborosan penelitian [ 5 ]. Selain itu, uji klinis yang direncanakan dan dilaksanakan dengan buruk menimbulkan masalah etika karena partisipan mungkin terpapar risiko yang tidak perlu tanpa manfaat potensial apa pun [ 6 , 7 ].
Pada tahun 2019, Zarin dan rekan-rekannya memperkenalkan konsep ‘uji coba yang tidak informatif’ untuk menggambarkan uji coba yang dirancang, dilakukan, dan dilaporkan dengan cara yang gagal memenuhi harapan peserta bahwa keterlibatan mereka akan memajukan ilmu kedokteran [ 8 ]. Sebaliknya, Zarin dan rekan-rekannya lebih lanjut menggambarkan ‘uji coba informatif’ sebagai uji coba yang memenuhi lima kondisi utama untuk keinformatifan [ 8 , 9 ]:
1.
Pentingnya: hipotesis uji coba kemungkinan akan memberikan informasi mengenai keputusan ilmiah, medis, atau kebijakan yang penting;
2.
Desain: metode uji coba kemungkinan besar memberikan bukti yang berarti terkait dengan hipotesis penelitian;
3.
Kelayakan: uji coba harus dapat dibuktikan kelayakannya (misalnya, harus memiliki rencana realistis untuk merekrut peserta dalam jumlah yang cukup);
4.
Integritas: uji klinis harus dilakukan dan dianalisis dengan cara yang sah secara ilmiah dan sesuai dengan rancangannya; dan
5.
Pelaporan: sistem diterapkan untuk memastikan pelaporan yang tepat waktu, lengkap, dan akurat.
Studi lebih lanjut tentang kondisi keinformatifan oleh Hutchinson dan rekan-rekannya menyimpulkan bahwa sebagian besar uji coba yang dirancang untuk memandu praktik klinis memiliki fitur yang dapat melemahkan kemampuan mereka untuk melakukannya [ 9 ]. Sementara beberapa penyandang dana atau sponsor uji coba memiliki proses tinjauan ilmiah pasca-pendanaan, tinjauan sejawat pra-pendanaan tetap menjadi metode utama untuk mengevaluasi uji coba non-industri. Oleh karena itu, peningkatan jumlah uji coba informatif juga memerlukan peningkatan proses tinjauan pra-pendanaan.
Tinjauan cepat ini memberikan wawasan dari penelitian global yang bertujuan untuk meningkatkan keinformatifan sesuai dengan lima kondisi yang dijelaskan oleh Zarin dan rekan-rekannya, khususnya jika penelitian tersebut menyajikan rekomendasi untuk perbaikan. Memahami proses ini dapat meningkatkan tinjauan sejawat sebelum pendanaan, sehingga meningkatkan kemungkinan menghasilkan uji klinis yang informatif.
2 Metode
Kami melakukan tinjauan cepat yang diinformasikan oleh panduan metodologis dari Cochrane Rapid Reviews Methods Group dengan penekanan pada pemeliharaan metode yang sistematis, transparan dan dapat direproduksi melalui proses tinjauan yang dipercepat [ 10 ]. Protokol untuk tinjauan tersebut dikembangkan dan diterbitkan pada PROSPERO (CRD42024541229) [ 11 ].
2.1 Kriteria Kelayakan
Penelitian untuk inklusi membahas proses desain uji coba yang diharapkan dapat meningkatkan keinformatifan, seperti satu atau lebih dari lima kondisi yang dikemukakan Zarin dan rekan-rekannya: 1) Penting, 2) Desain, 3) Kelayakan, 4) Integritas, dan 5) Pelaporan [ 8 ]. Ini termasuk pendekatan yang diusulkan atau dievaluasi untuk meningkatkan desain uji coba yang dapat meningkatkan peluang uji coba yang informatif, menggunakan metodologi apa pun. Kriteria inklusi dan eksklusi lengkap untuk tinjauan tersedia melalui protokol [ 11 ].
2.2 Sumber Informasi dan Strategi Pencarian
Strategi pencarian komprehensif dikembangkan dan diujicobakan dengan bantuan spesialis informasi dan disajikan dalam Informasi Pendukung S1: Materi Pendukung 1. MEDLINE (Ovid) ditelusuri untuk literatur yang relevan dari Januari 2014 hingga Mei 2024 saat pencarian dilakukan. Tidak ada batasan bahasa yang diterapkan pada awalnya dengan bahasa Inggris digunakan sebagai filter pembatas akhir. Karena jangka waktu tinjauan cepat ini, pencarian tidak dijalankan ulang sebelum analisis akhir dan studi yang tidak dipublikasikan tidak dicari.
2.3 Pemilihan Studi
Semua referensi yang diidentifikasi oleh strategi pencarian diunggah ke EndNote X9 dan program perangkat lunak Evidence for Policy and Practice Information (EPPI-Reviewer 5) untuk penghapusan duplikat lebih lanjut. EPPI-Reviewer direkomendasikan oleh Cochrane untuk semua bentuk peninjauan dan menggunakan pembelajaran mesin untuk memajukan proses penyaringan dengan cepat [ 12 ].
Setelah duplikat dihapus, penyaringan manual judul dan abstrak dilakukan oleh satu peninjau (SP) pada 20% kutipan yang diambil. Hal ini memungkinkan penggunaan model pengklasifikasi dalam perangkat lunak EPPI-Reviewer untuk mengidentifikasi kutipan lebih lanjut yang dinilai perangkat lunak memiliki probabilitas inklusi sebesar 50% atau lebih besar berdasarkan hasil sampel 20%.
Penyaringan manual 10% dilakukan oleh dua peninjau (SP dan ST) terhadap artikel yang ditempatkan oleh Peninjau EPPI dalam rentang probabilitas rendah 40%–50% dan 30%–40%, di mana kesepakatan dicapai bahwa tidak ada kutipan relevan yang dikecualikan dan bahwa Peninjau EPPI mengidentifikasi kutipan dengan tepat. Kutipan untuk pengambilan teks lengkap disetujui oleh tiga peninjau (SP, ST, dan HB). Teks lengkap kemudian dinilai oleh satu peninjau (SP), dengan peninjau kedua (ST) menilai 10% untuk mencapai konsensus tentang pencantuman dalam tinjauan.
2.4 Ekstraksi Data
Formulir ekstraksi data dikembangkan untuk menangkap hal-hal spesifik penelitian, termasuk rincian kutipan, cakupan geografis, rincian pendanaan, jenis intervensi atau intervensi yang diusulkan, relevansi dengan Zarin dan rekan-rekannya, dan hasil utama atau hasil yang diantisipasi. Formulir ekstraksi data disajikan dalam Informasi Pendukung S2: Materi Pendukung 2 .
2.5 Sintesis dan Analisis
Kami memutuskan secara apriori untuk mengakui sifat heterogen dari penelitian ini, dan untuk dipandu oleh bukti yang disajikan oleh penulis literatur yang disertakan ketika mempertimbangkan beragam proses yang memengaruhi keinformatifan uji klinis. Teks lengkap kutipan yang diidentifikasi untuk disertakan diunggah ke NVivo 12 untuk analisis tematik lebih lanjut.
Lima syarat Zarin dan kolega untuk sifat informatif (1) Pentingnya, 2) Desain, 3) Kelayakan, 4) Integritas dan 5) Pelaporan) digunakan untuk analisis tematik. Seorang peninjau (SP) mengidentifikasi dan mengkodekan contoh-contoh proses yang relevan (diusulkan atau diterapkan) dari literatur menurut setiap tema dan temuan-temuan utama dirangkum dalam bentuk tabel. Contoh-contoh pendukung tambahan dari proses-proses ini, atau alat-alat yang disarankan untuk mendukung desain uji coba yang informatif, juga dikumpulkan untuk sintesis dan diskusi lebih lanjut. Karena ini adalah tinjauan cepat yang mencakup penelitian dalam berbagai konteks, tidak ada sintesis kuantitatif atau meta-analitis dari temuan-temuan yang dilakukan.
3 Hasil
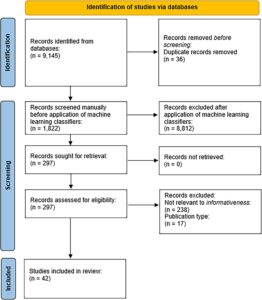
Gambar 1 merangkum hasil proses pemilihan publikasi dalam diagram bergaya PRISMA. Sebanyak 42 artikel teks lengkap disertakan dalam tinjauan akhir.
3.1 Tinjauan Umum Teks yang Termasuk
Tabel 1 merangkum latar geografis penelitian, atau afiliasi geografis penulis penerbit, dan sebagian besar mencerminkan penelitian dari Amerika Serikat (AS; 28,6%) dan Inggris (Inggris Raya; 21,4%). Penelitian dengan fokus global (11,9%) mencakup tiga atau lebih wilayah geografis yang berbeda.
| Latar geografis penelitian (atau afiliasi geografis penulis yang menerbitkan) | % ( n = 42) sebuah |
|---|---|
| Amerika Serikat | 28,6% |
| Inggris Raya | 21,4% dari total |
| Global (studi yang terdiri dari tiga atau lebih wilayah geografis yang berbeda) | 11,9% |
| Afrika Sub-Sahara | 7,1% dari |
| Eropa (secara umum) | 7,1% dari |
| Eropa + Inggris Raya | 7,1% dari |
| Kanada + Inggris Raya | 7,1% dari |
| Eropa + Amerika Serikat | 4,8% |
| Australia + Selandia Baru | 2,4% |
| Kanada + Amerika Serikat | 2,4% |
| Pendana dan/atau sponsor penelitian | % ( n = 42) sebuah |
|---|---|
| Pemerintah | 31% |
| Pendanaan tidak disebutkan | 19% |
| Tidak ada pendanaan khusus yang diterima | 16,7% |
| Amal | 9,5% dari total |
| Amal + pemerintah | 7,1% dari |
| Industri | 4,8% |
| Dewan penelitian | 2,4% |
| Amal + akademis | 2,4% |
| Akademisi + pemerintah + dewan penelitian | 2,4% |
| Pemerintah + jaringan kolaboratif lainnya | 2,4% |
| Jaringan kolaboratif lainnya | 2,4% |
a mungkin tidak sama dengan 100% karena pembulatan.
Tabel 1 juga merinci penyandang dana dan/atau sponsor penelitian. Sekitar sepertiga penelitian disponsori oleh lembaga pemerintah global (31%) dengan Badan Pengawas Obat dan Makanan Amerika Serikat menjadi sponsor perorangan terbesar (4,8%). Informasi pendanaan tidak diberikan untuk 19% penelitian yang tercatat, sementara 16,7% publikasi memberikan transparansi lebih lanjut dengan menyatakan bahwa tidak ada pendanaan khusus yang diterima.
3.2 Meningkatkan Informatif Melalui Proses Desain Uji Coba
Sebanyak 27 proses atau tindakan yang direkomendasikan untuk meningkatkan keinformatifan tertangkap dalam tinjauan cepat. Sebagian besar rekomendasi ini relevan dengan kondisi kedua Zarin dan kolega untuk keinformatifan—2) Desain (~44%). Tabel 2 merangkum rekomendasi tersebut bersama dengan deskriptor pendukung dan contoh lebih lanjut dari badan penelitian.
| Proses atau tindakan yang direkomendasikan untuk meningkatkan informasi | Contoh pendukung dari literatur |
|---|---|
| 1. Pentingnya: hipotesis percobaan kemungkinan akan menginformasikan keputusan ilmiah, medis atau kebijakan yang penting | |
| 1.1. Menerapkan proses formal penentuan prioritas atau agenda penelitian yang memanfaatkan struktur dan sistem yang ada | Identifikasi dan prioritas pertanyaan penelitian melalui sintesis bukti (termasuk tinjauan sistematis, tinjauan cakupan dan bentuk pemetaan bukti lainnya [ 13 – 16 ]), Nilai Informasi (VOI) dan analisis ekonomi lainnya [ 17 , 18 ], dan konsultasi pemangku kepentingan [ 19 ] |
| 1.2. Mengembangkan inisiatif peningkatan kualitas yang sesuai dengan tujuan (misalnya, selaras dengan tujuan penelitian) untuk mendukung konseptualisasi awal pertanyaan penelitian. | Pertimbangkan apakah definisi dan kerangka kerja kualitas saat ini (misalnya, INQUIRE [ 20 ]) dalam penelitian uji klinis selaras dengan tujuan penelitian dan bagaimana inisiatif peningkatan kualitas mungkin berbeda untuk lingkungan dengan sumber daya terbatas [ 21 , 22 ] |
| 1.3. Melibatkan pasien sebagai mitra pada awal proses pengembangan uji klinis | Penekanan pada peran pasien dalam membimbing pengembangan hipotesis percobaan untuk lebih baik mengatasi masalah yang penting bagi pasien dan sehingga intervensi yang diusulkan lebih mungkin dilihat oleh pasien sebagai sesuatu yang dapat diterima [ 23 , 24 ] |
| 1.4. Memperluas dan memformalkan praktik penelitian tradisional melalui Open Science (OS) | Pra-pendaftaran proyek prospektif pada platform online atau penyerahan laporan terdaftar di mana hipotesis, desain eksperimen dan rencana analitik ditentukan sebelum pengumpulan data [ 25 , 26 ] |
| 2. Desain: metode uji coba kemungkinan besar memberikan bukti yang berarti terkait dengan hipotesis penelitian | |
| 2.1. Memilih alat yang sesuai dengan tujuan untuk lebih mendukung proses desain uji klinis yang terinformasi | Desain uji coba dapat ditingkatkan lebih lanjut melalui penggunaan alat desain yang tepat (lihat Tabel 3 ) serta platform manajemen menyeluruh (misalnya, dari awal uji coba hingga pelaporan akhir) [ 22 ] dan kerangka kerja atau dokumen panduan lainnya yang dimaksudkan untuk mengurangi pemborosan penelitian [ 19 , 27 – 29 ] |
| 2.2. Menetapkan forum penelitian dan jaringan kolaboratif lainnya sebagai sumber umpan balik dan dukungan desain uji coba. | Forum penelitian dan jaringan kolaboratif lainnya dapat memberikan masukan yang berguna ketika mempertimbangkan desain dan pelaksanaan uji klinis, seperti memperoleh persetujuan, pengelolaan data, dan mengembangkan hubungan kerja yang baik dengan penyandang dana [ 30 – 32 ]; lingkungan dengan sumber daya terbatas juga dapat memperoleh manfaat unik dari kolaborasi lebih lanjut ketika mempertimbangkan desain dan pelaksanaan uji klinis [ 33 ] |
| 2.3. Jika sesuai, pertimbangkan pendekatan desain uji coba pragmatis yang mengevaluasi efektivitas intervensi dalam kondisi dunia nyata. | Alat desain seperti PRECIS-2 [ 34 ] dan GetReal Trial Tool [ 35 ] dapat membantu mengonseptualisasikan dan menginformasikan elemen penjelasan dan/atau pragmatis dari desain uji coba dengan tujuan menciptakan uji coba yang sesuai dengan keputusan desain dengan tujuan pengambilan keputusan yang dimaksudkan dari uji coba tersebut. |
| 2.4. Mengintegrasikan pendekatan yang berpusat pada pasien di seluruh proses desain uji klinis (misalnya, mempertimbangkan berbagai pertimbangan peserta seperti kemudahan, rasio risiko terhadap manfaat, interaksi sosial, kemitraan, dan altruisme) | Pertimbangan kebutuhan pasien, terutama pada pengembangan uji klinis tahap awal, dapat menghasilkan lebih sedikit perubahan protokol, peningkatan titik akhir, peningkatan kelayakan (rekrutmen dan retensi) dan kepuasan pasien yang lebih tinggi [ 24 , 36 ] |
| 2.5. Mempertimbangkan keberagaman keahlian dalam tim uji coba untuk memastikan kondisi informatif dimasukkan ke dalam semua aspek perencanaan dan pelaksanaan uji coba. | Keahlian harus dicari di semua bidang desain dan pengembangan uji klinis termasuk teknologi informasi, pengembangan data, pengembangan protokol ilmiah, urusan klinis dan operasi keuangan; keberagaman khususnya relevan dengan uji klinis multisenter di mana keahlian dapat mencakup beberapa tim yang bekerja untuk mencapai hasil bersama [ 36 , 37 ] |
| 2.6. Mencari panduan protokol dan umpan balik lebih lanjut dari staf dan anggota tim lokasi uji coba yang diantisipasi | Keterlibatan staf lapangan dalam pengembangan protokol dapat meningkatkan pemahaman konteks, kapasitas dan budaya lokal serta memastikan bahwa anggota tim yang diantisipasi memahami protokol sebelum dimulainya uji coba [ 36 ] |
| 2.7. Menggunakan data registrasi yang ada untuk memberikan informasi lebih lanjut mengenai desain uji klinis | Potensi penerapan data registrasi yang ada termasuk memberikan informasi mengenai aspek desain uji klinis seperti ukuran sampel [ 38 ], atau penggunaan alat tambahan untuk memprediksi penghentian awal uji klinis berdasarkan hasil sebelumnya [ 39 , 40 ] |
| 2.8. Pembahasan lebih lanjut mengenai isu-isu etika kritis dalam pengembangan protokol uji klinis | Pembahasan substantif mengenai isu etika tertentu jarang dimasukkan dalam protokol uji klinis dan pedoman pelaporan saat ini (misalnya, SPIRIT [ 41 ], CONSORT [ 42 ]) mungkin tidak cukup mendukung penulis protokol, tim studi, sponsor, komite etik dan pengulas dalam menangani isu etika secara memadai [ 43 ] |
| 2.9. Akuntabilitas dari penyandang dana dan/atau sponsor uji klinis untuk memastikan pertimbangan desain uji klinis tepat dan cukup beralasan | Pendana dan/atau sponsor uji coba harus mempertanyakan pemilihan dan validasi hasil, intervensi dan pembanding, ukuran sampel dan tindak lanjut yang disarankan dalam desain uji coba; skala validasi (misalnya, COMET [ 44 ]) dapat membantu dalam memilih ukuran yang tepat [ 45 ] |
| 2.10. Memanfaatkan penilaian manfaat-risiko untuk uji coba dengan lebih dari satu hasil yang diinginkan (misalnya, uji coba superioritas, kesetaraan, dan non-inferioritas) | Metodologi manfaat-risiko dapat digunakan untuk menilai hasil secara simultan dan mempertimbangkan pertimbangan-pertimbangan yang ada sambil membantu memastikan hipotesis penelitian dijawab dengan tepat (misalnya, efektivitas hasil kesehatan utama, relatif terhadap keamanan dan biaya) [ 46 ] |
| 2.11. Melakukan tinjauan desain ilmiah setelah proses tinjauan sejawat tetapi sebelum komitmen pendanaan | Sebelum pendanaan uji coba, pertimbangan lebih lanjut mengenai desain uji coba, biostatistik dan metode penelitian diperlukan untuk meningkatkan pemahaman mengenai informasi uji coba dan mengurangi pemborosan penelitian [ 47 ] |
| 2.12. Meningkatkan kelengkapan protokol uji klinis dengan meningkatkan data hasil yang dilaporkan pasien (PRO) | Konten PRO dalam uji klinis seringkali kurang optimal meskipun memberikan bukti berharga untuk menginformasikan pengambilan keputusan bersama, klaim pelabelan, panduan klinis dan kebijakan kesehatan; penggunaan pedoman pendukung (misalnya SPIRIT-PRO) dapat memberikan rekomendasi untuk item yang harus dimasukkan dalam protokol di mana PRO merupakan hasil utama atau hasil sekunder yang utama [ 48 ] |
| 2.13. Menerapkan pendekatan ‘kualitas berdasarkan desain’ pada uji klinis | Pendekatan ‘kualitas berdasarkan desain’ memungkinkan organisasi untuk memprioritaskan faktor penentu paling penting dari kualitas uji klinis, mengidentifikasi aktivitas yang tidak penting yang dapat dihilangkan untuk memperlancar pelaksanaan dan pengawasan uji klinis, dan merumuskan rencana yang tepat untuk menentukan, menghindari, mengurangi, memantau, dan mengatasi kesalahan penting [ 49 ] |
| 3. Kelayakan: uji coba harus dapat dibuktikan kelayakannya (misalnya, harus memiliki rencana realistis untuk merekrut peserta yang cukup) | |
| 3.1. Mengintegrasikan bukti kualitatif ketika menilai kelayakan uji klinis | Temuan penelitian kualitatif dapat lebih jauh mengeksplorasi pengalaman hidup seseorang yang menderita suatu penyakit, misalnya bekerja di dalam sistem layanan kesehatan tertentu, dan hambatan serta faktor pendukung lainnya dalam berpartisipasi dalam suatu uji klinis [ 16 ] |
| 3.2. Jika sesuai, pertimbangkan studi percontohan atau studi kelayakan untuk menghindari pemborosan penelitian dan mengurangi risiko investasi pendanaan. | Studi kelayakan ditemukan berpotensi berguna dalam menilai apakah uji coba yang lebih mahal dan berskala besar layak dilakukan [ 50 ]; studi kelayakan uji coba pragmatis mungkin berbeda, dan harus mempertimbangkan tujuan kelayakan yang secara khusus relevan dengan area ketidakpastian untuk uji coba pragmatis [ 51 , 52 ] |
| 3.3. Memanfaatkan pengetahuan tenaga kesehatan setempat untuk memberikan informasi yang lebih baik mengenai studi kelayakan atau studi percontohan. | Integrasi tenaga kesehatan lokal dalam proses uji klinis dapat memberikan konteks lebih lanjut mengenai masalah rekrutmen dan retensi, dan membantu memastikan bahwa jumlah sampel yang dibutuhkan dapat tercapai [ 33 ] |
| 3.4. Melibatkan anggota komunitas dalam strategi rekrutmen dan retensi peserta | Konsep komunitas akan berbeda-beda tergantung pada konteks global, namun mungkin relevan khususnya di lingkungan dengan sumber daya terbatas ketika mempertimbangkan kelayakan uji klinis; anggota komunitas dapat memberikan umpan balik yang berharga dalam strategi retensi seperti praktik terbaik untuk komunikasi dengan calon peserta uji klinis [ 33 ] |
| 4. Integritas: Uji klinis harus dilakukan dan dianalisis dengan cara yang sah secara ilmiah dan sesuai dengan rancangannya. | |
| 4.1. Informasi eksternal lebih lanjut tentang efek pengobatan harus digunakan untuk menginformasikan aspek analisis uji klinis. | Sintesis bukti dari sumber eksternal dapat memberikan informasi yang lebih baik mengenai aspek analisis uji klinis, termasuk pemahaman lebih jauh mengenai efek pengobatan (misalnya melalui meta-analisis atau perbandingan tidak langsung), dan pengurangan bias dalam penyajian analisis dan hasil uji klinis [ 15 ] |
| 4.2. Pengembangan lebih lanjut pelatihan berbasis keterampilan untuk memastikan pelaksanaan uji klinis yang berkualitas | Praktik klinis yang baik (Good Clinical Practice/GCP) menjelaskan pertimbangan ilmiah dan etika yang terlibat dalam pelaksanaan uji klinis yang berkualitas; tim uji klinis dapat memperoleh manfaat dari pelatihan tambahan di luar sertifikasi GCP dalam memperoleh persetujuan yang diinformasikan, memastikan kepatuhan terhadap protokol, dan melindungi kesehatan dan keselamatan peserta [ 32 , 53 ] |
| 4.3. Pendaftaran Unit Uji Klinis (CTU) dalam jaringan nasional atau internasional yang lebih luas | Menjaga kapasitas untuk pengembangan dan penyampaian uji klinis berkualitas tinggi dengan memastikan kompetensi utama untuk pelaksanaan uji klinis terpenuhi dalam CTU di bawah bimbingan keahlian yang sesuai [ 31 ] |
| 5. Pelaporan: sistem tersedia untuk memastikan pelaporan yang tepat waktu, lengkap dan akurat. | |
| 5.1. Persyaratan wajib untuk mendaftarkan uji klinis secara proaktif beserta sistem pemantauan pendukung untuk memastikan kepatuhan terhadap pendaftaran, pencatatan terkini dan publikasi hasil yang tepat waktu. | Dengan mengumumkan secara terbuka rincian mengenai metodologi dan pelaksanaan uji klinis sebelum mendaftarkan partisipan, maka transparansi akan meningkat, pelaporan yang selektif dan bias publikasi akan berkurang, dan memastikan adanya tanggung jawab etis untuk melaporkan hasil uji klinis kepada publik [ 26 , 54 ] |
| 5.2. Pelaporan lebih lanjut dalam registri yang sesuai | Registri dan basis data pasien dapat mendukung penelitian klinis dan mungkin penting dalam menilai kelayakan uji klinis untuk beberapa bidang seperti penyakit langka atau penyakit langka; pelaporan harus mempertimbangkan relevansi uji klinis dengan penelitian di masa depan dan memberikan kontribusi pada registri jika diperlukan [ 38 ] |
| 5.3 Pelaporan pertimbangan kesetaraan kesehatan | Transparansi dan kelengkapan dalam proses pelaporan uji klinis harus mempertimbangkan bagaimana penyajian intervensi dan hasil uji klinis dapat mempengaruhi pembuatan kebijakan dan keputusan lain bagi mereka yang saat ini kurang terlayani oleh penelitian dan layanan kesehatan [ 28 ] |
3.3 Alat untuk Meningkatkan Informasi Uji Coba
Rekomendasi utama dari penelitian ini adalah penggunaan ‘alat’ untuk meningkatkan keinformatifan uji klinis (misalnya, Rekomendasi 2.1 pada Tabel 2 ). Tinjauan ini tidak mencari alat secara khusus. Namun, menjadi jelas bahwa alat membentuk titik diskusi yang signifikan dalam topik keinformatifan uji klinis. Alat yang disajikan sebagai penelitian mandiri dalam tinjauan ini, atau yang digunakan untuk memfasilitasi keterlibatan aktif dalam proses desain uji klinis yang lebih luas, dirangkum dalam Tabel 3. Sebanyak 23 alat diidentifikasi di seluruh kondisi Zarin dan rekan-rekannya yaitu 1) Pentingnya (17%), 2) Desain (74%) dan 5) Pelaporan (9%). Kutipan tambahan disediakan jika alat tersedia melalui Akses Terbuka atau platform digital lainnya.
| Alat pendukung | Keterangan |
|---|---|
| 1. Pentingnya: hipotesis percobaan kemungkinan akan menginformasikan keputusan ilmiah, medis atau kebijakan yang penting | |
| Sistem Mutu Peningkatan Kualitas Data Praklinis (EQIPD) [ 22 ] |
|
| Peta bukti [ 13 ] |
|
| Alat multi-kriteria untuk mengevaluasi proposal penelitian [ 60 ] |
|
| Analisis Nilai Informasi (VOI) [ 17 , 18 ] |
|
| 2. Desain: metode uji coba kemungkinan besar memberikan bukti yang berarti terkait dengan hipotesis penelitian | |
| Alat Penilaian Beban Kerja Uji Klinis American Society of Oncology (ASCO) [ 30 ] |
|
| Alat Penilaian Karakterisasi Pragmatik-Penjelasan (ASPECT-R) [ 56 ] |
|
| Perangkat Inisiatif Transformasi Uji Klinis (CTTI) ‘kualitas berdasarkan desain’ [ 49 ] |
|
| Penambangan data [ 40 ] |
|
| Faktor-faktor yang menginformasikan desain uji coba yang paling mungkin (superioritas, kesetaraan dan non-inferioritas) [ 46 ] |
|
| Alat Uji Coba GetReal [ 35 ] |
|
| Peta Proses Penelitian Kesehatan Global [ 33 ] |
|
| Kerangka kerja desain ekuitas kesehatan [ 28 ] |
|
| Platform crowdsourcing berbasis internet [ 63 ] |
|
| Pembelajaran mesin [ 39 ] |
|
| Model kematangan untuk tinjauan ilmiah desain uji klinis [ 47 ] |
|
| Piramida Motivasi Pasien [ 24 ] |
|
| Alat Penulis PONTE (PAT) [ 57 ] |
|
| Ringkasan Indikator Kontinum Pragmatis–Penjelasan (PRECIS-2) [ 34 ] |
|
| Kit Alat Etika Protokol [ 43 ] |
|
| Ekstensi SPIRIT-PRO [ 48 ] |
|
| Kotak alat Jaringan Inovasi Uji Coba (TIN) [ 37 ] |
|
| 5. Pelaporan: sistem tersedia untuk memastikan pelaporan yang tepat waktu, lengkap dan akurat. | |
| Daftar periksa untuk pelaporan metode manfaat–risiko [ 46 ] |
|
| Daftar periksa desain registri [ 38 ] |
|
3.4 Penerapan Temuan pada Proses Tinjauan Sejawat Pra-Pendanaan
Sekitar 10% dari penelitian yang kami ulas secara luas membahas sistem peer review pra-pendanaan. Ada penekanan pada perlunya proses peer review yang lebih berkualitas untuk memastikan bahwa hanya penelitian yang paling menjanjikan dan relevan yang didanai [ 25 , 47 ]. Kebutuhan akan keahlian yang relevan juga disorot, termasuk masukan dari mereka yang sebelumnya telah melakukan atau berkontribusi pada proses peer review yang sukses [ 31 , 33 ]. Sementara banyak temuan dari Tabel 2 mungkin berlaku untuk peer review pra-pendanaan, penelitian lebih lanjut diperlukan sebelum rekomendasi tambahan dapat dibuat.
4 Diskusi
Tinjauan cepat ini berupaya memberikan wawasan tentang proses desain uji coba yang dapat ditindaklanjuti yang dapat meningkatkan keinformatifan uji coba seperti yang dijelaskan oleh Zarin dan rekan-rekannya [ 8 , 9 ]. Konsep uji coba ‘informatif’ masih berkembang dan sementara pemborosan penelitian dapat terjadi pada tahap apa pun, uji coba informatif berupaya untuk menghilangkan pemborosan sama sekali. Pada tahun 2023, Organisasi Kesehatan Dunia menguraikan rancangan praktik terbaik untuk uji klinis di mana ‘uji coba yang baik’ telah dijelaskan sebagai uji coba yang ‘memberikan informasi yang andal, etis dan efisien dan menjawab pertanyaan-pertanyaan penting secara ilmiah yang relevan dengan populasi yang ingin diberi manfaat’ [ 55 ]. Kondisi keinformatifan Zarin dan rekan-rekannya memberikan beberapa ukuran pertama untuk menentukan dan mengevaluasi apa yang membuat uji coba ‘memberikan informasi yang andal’.
Yang membedakan tinjauan cepat ini dari literatur saat ini adalah sintesis proses dan bagaimana rekomendasi, contoh, dan alat yang berdiri sendiri mencerminkan kebutuhan akan perubahan tingkat atas yang lebih luas. Misalnya, dalam kondisi pertama Zarin dan koleganya tentang 1) Pentingnya, sebagian besar penelitian menekankan perlunya proses formal untuk memprioritaskan pertanyaan penelitian yang mengisi kesenjangan bukti saat ini. Hal ini ditegaskan oleh contoh-contoh yang menunjukkan nilai sintesis bukti yang berbeda, perlunya analisis ekonomi, dan bagaimana prioritas pemangku kepentingan dapat memengaruhi penetapan agenda. Contoh-contoh ini menyoroti bagaimana hipotesis uji coba yang tidak didefinisikan dengan baik berkontribusi pada pemborosan penelitian, dan bagaimana duplikasi upaya dalam mendanai penelitian yang sebelumnya diteliti atau penelitian yang diidentifikasi serupa secara eksplisit gagal untuk meningkatkan keinformatifan.
Sepanjang proses atau tindakan yang direkomendasikan untuk meningkatkan keinformatifan sebagaimana relevan dengan kondisi kedua Zarin dan koleganya, 2) Desain, ada kebutuhan untuk memastikan metode uji coba sesuai dengan tujuannya, yaitu, metode dan pilihan desain sesuai dan mencerminkan tujuan uji coba yang dimaksud. Dalam mempertimbangkan generalisasi hasil uji coba, beberapa penulis membahas manfaat desain uji coba pragmatis di mana efektivitas intervensi dievaluasi dalam kondisi yang dekat dengan kondisi di mana intervensi akan digunakan secara rutin, jika terbukti efektif [ 33-35 , 51 , 56 ]. Namun, setiap uji coba yang diberikan mungkin mengandung elemen pragmatis dan lebih bersifat penjelasan [ 34 , 35 , 56 ] . Di sinilah alat desain, seperti yang tercantum dalam Tabel 3 , bermanfaat saat mempertimbangkan keinformatifan uji coba. Alat yang paling banyak dirujuk sepanjang tinjauan adalah PRECIS-2, yang bertujuan untuk membantu mereka yang merancang uji coba untuk secara proaktif mempertimbangkan di mana mereka ingin uji coba mereka berada pada kontinum pragmatis/penjelasan [ 34 ].
Sementara alat yang tervalidasi seperti PRECIS-2 adalah standar saat ini, tinjauan tersebut juga menangkap beberapa penggunaan kecerdasan buatan secara konseptual dan terapan [ 39 , 40 , 57 ]. Contoh-contoh ini sebagian besar memanfaatkan pengetahuan terkini tentang uji coba yang berhasil untuk menginformasikan praktik desain masa depan dan kemungkinan akan menjadi area utama pengembangan lebih lanjut mengingat laju transformasi digital yang cepat di semua bidang perawatan kesehatan dan sosial. Kemajuan digital juga mencakup praktik Sains Terbuka (OS), yang dapat mendukung proses desain awal dan pelaksanaan serta pelaporan uji coba yang sedang berlangsung [ 25 ]. Praktik OS seperti pra-pendaftaran proyek prospektif pada platform daring atau mengirimkan laporan terdaftar lebih lanjut mendukung keinformatifan uji coba dengan memungkinkan orang lain mengakses informasi yang relevan, termasuk akses publik ke penelitian yang sedang berlangsung. Studi juga menunjukkan bahwa peneliti yang berbagi data ‘menghasilkan temuan dengan lebih sedikit kesalahan, sehingga menunjukkan lebih banyak ketekunan dalam praktik dan pelaporan ilmiah’ [ 25 ].
Sebagian besar penelitian yang tercakup dalam tinjauan ini berasal dari AS (28,6%) atau Inggris (21,4%). Namun, aspek desain uji coba yang sesuai dengan tujuan untuk pengaturan sumber daya rendah juga dicatat dalam konteks Afrika sub-Sahara [ 21 , 33 , 36 ]. Dalam hal ini, penulis melaporkan adanya kesenjangan antara prioritas dan harapan penyandang dana luar dan realitas merancang dan mengimplementasikan uji coba di pengaturan sumber daya rendah di mana sumber daya dan sistem perawatan kesehatan mungkin tidak memenuhi standar dunia kaya. Agar uji coba menjadi informatif dalam pengaturan sumber daya rendah, proses desain harus mempertimbangkan konteks regional, termasuk budaya [ 36 ]. Studi menemukan bahwa integrasi prospektif yang lebih baik dari komunitas lokal, profesional perawatan kesehatan, dan staf uji coba menghasilkan protokol berkualitas lebih baik yang memerlukan lebih sedikit amandemen dan kelayakan uji coba yang lebih baik secara keseluruhan [ 21 , 33 , 36 ].
Pentingnya rencana realistis untuk merekrut cukup banyak peserta uji coba tercermin dalam kondisi ketiga Zarin dan rekannya untuk keinformatifan, 3) Kelayakan. Ini termasuk kebutuhan untuk meningkatkan infrastruktur untuk melacak dan menangani masalah rekrutmen [ 8 ]. Kelayakan seperti yang dijelaskan oleh Zarin dan rekannya juga lebih jauh menyoroti bagaimana kondisi keinformatifan dapat berpotongan. Misalnya, studi kelayakan disarankan sebagai sarana untuk memastikan keputusan desain uji coba sesuai dengan tujuan pengambilan keputusan yang dimaksudkan dari hasil uji coba (yaitu, 2) Desain) dan dapat secara memadai menghasilkan bukti yang berarti terkait dengan hipotesis studi (yaitu, 1) Pentingnya) [ 50 , 51 ]. Komunikasi juga merupakan aspek kunci dalam memahami bagaimana kelayakan dapat ditingkatkan, seperti memasukkan anggota masyarakat yang relevan dan pakar kesehatan dalam desain strategi rekrutmen dan retensi [ 23 , 33 ].
Kondisi keempat Zarin dan koleganya untuk keinformatifan, 4) Integritas, mencerminkan proses atau perubahan yang dapat ditindaklanjuti baik pada tingkat individu maupun pertimbangan yang lebih luas dari Unit Uji Klinis atau jaringan uji terkait [ 31 , 53 ]. Tinjauan ini menemukan bahwa individu dan tim uji dapat memperoleh manfaat dari pelatihan praktis berbasis keterampilan tambahan untuk lebih jauh mengontekstualisasikan kepatuhan protokol dan aspek kesehatan dan keselamatan peserta, seperti memperoleh persetujuan yang diinformasikan [ 32 , 53 ]. Pentingnya keahlian dalam uji coba multi-pusat atau multi-situs di mana keberhasilan uji coba bergantung pada banyak individu dan kelompok yang bekerja sama untuk mencapai kondisi keinformatifan yang berbeda juga dicatat [ 36 , 37 ].
Kondisi terakhir untuk keinformatifan, 5) Pelaporan, difokuskan pada kebutuhan untuk mendaftarkan uji klinis secara proaktif sebelum mendaftarkan partisipan untuk meningkatkan transparansi dan mengurangi pelaporan selektif dan bias publikasi selanjutnya [ 26 , 54 ]. Mendaftarkan uji klinis secara proaktif juga memenuhi kewajiban etika sebagaimana yang digariskan oleh Deklarasi Helsinki yang menyatakan bahwa ‘setiap studi penelitian yang melibatkan subjek manusia harus didaftarkan dalam basis data yang dapat diakses publik sebelum perekrutan subjek pertama’ [ 7 ]. Hal ini didukung oleh Komite Internasional Editor Jurnal Medis yang menyarankan pertimbangan uji klinis untuk publikasi hanya jika didaftarkan sebagaimana mestinya [ 58 ]. Satu studi menemukan bahwa kurang dari setengah (42,9%) penyandang dana penelitian medis publik dan filantropi terbesar di Eropa memantau apakah uji klinis didaftarkan, yang selanjutnya mendukung perlunya peningkatan akuntabilitas di pihak penyandang dana atau sponsor untuk memastikan pelaporan uji klinis yang tepat [ 26 ].
Karena ini merupakan tinjauan cepat dari proses global yang dapat meningkatkan keinformatifan uji klinis, kami berupaya untuk menghemat sumber daya dengan menghilangkan elemen tinjauan sistematis tradisional, seperti mencari berbagai sumber atau menggabungkan literatur abu-abu. Perlu dicatat bahwa tinjauan cepat ini merupakan bagian pertama dari serangkaian pekerjaan yang juga akan mencakup analisis literatur abu-abu, termasuk panduan penyandang dana untuk pelamar, serta studi wawancara global dengan pihak-pihak terkait dalam penelitian uji klinis.
Kami menyadari bahwa konsep ‘informatif’ belum tersebar luas secara global dalam leksikon penelitian uji klinis dan bahwa metode tinjauan cepat kami mungkin telah menghilangkan pekerjaan lebih lanjut, seperti pra-cetak oleh Burford dan rekan-rekannya yang telah menyarankan daftar rekomendasi tambahan untuk meningkatkan informatifitas uji klinis kesehatan global [ 59 ]. Namun, dengan menargetkan sumber daya yang ditinjau sejawat dan diterbitkan, dan mempertimbangkan ini bersama dengan karya Zarin dan rekan-rekannya, kami telah mengidentifikasi proses atau tindakan lain yang dapat diterapkan oleh para peneliti uji klinis untuk meningkatkan informatifitas uji klinis. Ini dilengkapi dengan daftar alat desain uji klinis, yang banyak di antaranya tersedia melalui sumber daya Akses Terbuka atau platform digital lainnya.
5 Kesimpulan
Meskipun RCT dianggap sebagai ‘standar emas’ penelitian klinis, banyak yang tidak informatif dan berkontribusi pada pemborosan penelitian. Wawasan dari penelitian global yang dihimpun oleh tinjauan ini memberikan serangkaian rekomendasi yang ditujukan untuk meningkatkan keinformatifan uji klinis sesuai dengan lima kondisi yang diusulkan oleh Zarin dan rekan-rekannya. Meskipun tidak secara eksplisit dicari sebagai bagian dari tinjauan ini, pengembangan dan penggunaan ‘alat’ desain uji klinis ditemukan sebagai rekomendasi utama untuk meningkatkan keinformatifan. Penelitian lebih lanjut diperlukan tentang bagaimana proses desain uji klinis dapat lebih mendukung tinjauan sejawat prapendanaan, yang akan meningkatkan kemungkinan menghasilkan uji klinis yang informatif.