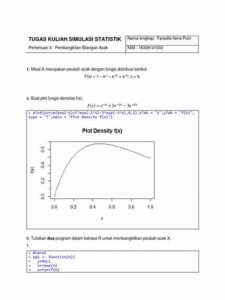
Abstrak
Protein saraf dalam aliran darah telah muncul sebagai biomarker yang menjanjikan untuk mendiagnosis penyakit Alzheimer (AD). Akan tetapi, penerapannya pada individu yang lebih tua dan mereka yang memiliki beberapa kondisi kesehatan yang ada bersamaan masih kurang diselidiki. Studi ini mengevaluasi potensi diagnostik neuro-marker berbasis darah pada partisipan berusia di atas 75 tahun menggunakan susunan molekul tunggal yang sangat sensitif. Kami merekrut 108 pasien rawat inap Tiongkok dengan usia rata-rata 92 tahun, termasuk 30 yang didiagnosis dengan AD, 46 yang didiagnosis dengan demensia yang tidak disebabkan oleh AD, dan 32 tanpa demensia. Konsentrasi plasma amiloid β-40 (Aβ40), amiloid β-42 (Aβ42), tau terfosforilasi pada treonin 181 (p-tau181), rantai ringan neurofilamen (NfL), dan protein asam fibrilar glial (GFAP) dalam plasma diukur bersama dengan rasio Aβ42/Aβ40. Hubungan antara biomarker ini dan karakteristik klinis (komorbiditas dan indikator fisiologis) diperiksa. Model diagnostik dikembangkan menggunakan regresi logistik biner berdasarkan neuro-marker ini. Di antara keenam neuro-marker, p-tau181 menunjukkan daya diskriminatif tertinggi untuk identifikasi AD, dengan area di bawah kurva (AUC) sebesar 0,7731 (95% CI: 0,6493–0,8969). Model yang menggabungkan p-tau181, GFAP, dan usia mencapai AUC sebesar 0,8654 (95% CI: 0,7762–0,9546), dengan sensitivitas 75,9% dan spesifisitas 80,6% dalam membedakan AD dari individu tanpa demensia. Temuan ini menunjukkan bahwa biomarker plasma neurodegenerasi, khususnya p-tau181, mungkin memiliki janji signifikan sebagai alat diagnostik untuk AD, bahkan di antara pasien yang lebih tua. Model diagnostik yang disederhanakan berdasarkan neuro-marker plasma menawarkan pendekatan yang layak untuk skrining AD dalam pengaturan klinis dan komunitas.
Poin-poin penting
Apa yang diketahui tentang topik ini?
- Sifat invasif dari pungsi lumbal untuk cairan serebrospinal (CSF) dan mahalnya biaya pencitraan tomografi emisi positron (PET) sering menyebabkan rendahnya kepatuhan pasien penyakit Alzheimer (AD) dan rendahnya kemungkinan diagnosis dini. Biomarker darah tepi telah muncul sebagai alternatif yang lebih baik daripada CSF dan PET karena kemudahannya dan sifatnya yang minimal invasif.
- Perhatian terbatas diberikan terhadap diagnosis AD pada individu berusia 75 tahun dan lebih tua.
Apa yang ditambahkan penelitian ini?
- Penelitian ini bertujuan untuk mengevaluasi potensi diagnostik penanda saraf berbasis darah pada kelompok pasien rawat inap lanjut usia dengan menggunakan rangkaian molekul tunggal yang sangat sensitif.
- Biomarker plasma neurodegenerasi, khususnya p-tau181, memiliki potensi signifikan sebagai indikator diagnostik AD, bahkan di kalangan populasi setengah baya dan tertua.
1. PENDAHULUAN
Penyakit Alzheimer (AD) merupakan kelainan neurodegeneratif yang umum terjadi dan merupakan jenis demensia yang paling umum. 1 Dengan semakin bertambahnya populasi yang menua, diagnosis AD yang tepat waktu—masalah kesehatan masyarakat global yang signifikan 2 —sangat penting untuk meningkatkan kualitas hidup pasien dan meringankan beban sosial.
Saat ini, standar emas untuk diagnosis AD adalah pencitraan tomografi emisi positron (PET) dan analisis cairan serebrospinal (CSF). 3 , 4 Namun, invasifitas pungsi lumbal yang diperlukan untuk pengambilan sampel CSF dan tingginya biaya pencitraan PET 2 , 5 sering menyebabkan kepatuhan pasien yang rendah dan tingkat diagnosis dini yang rendah selanjutnya. Akibatnya, biomarker darah tepi telah muncul sebagai alternatif yang lebih baik daripada CSF dan PET karena kenyamanannya dan sifatnya yang minimal invasif. 2 , 6 Meskipun potensinya, pengembangan biomarker berbasis darah yang andal tetap menjadi tantangan yang signifikan. Hal ini sebagian besar disebabkan oleh sawar darah-otak (BBB), yang menghasilkan konsentrasi biomarker terkait AD yang sangat rendah dalam darah (berkisar dari femtogram hingga pikogram per mL). 7 , 8
Dalam beberapa tahun terakhir, kemajuan signifikan dalam metode deteksi ultrasensitif—seperti teknologi Single Molecule Array (SiMoA)—telah sangat meningkatkan kuantifikasi biomarker darah untuk diagnosis AD. Metode ini menawarkan sensitivitas yang 1000 kali lebih tinggi daripada immunoassay tradisional, 9 , 10 secara signifikan meningkatkan efektivitas diagnostik biomarker darah. Metode ini telah memungkinkan banyak penelitian untuk menyoroti kemanjuran diagnostik tau terfosforilasi plasma pada threonine 181 (p-tau181) dalam membedakan pasien AD dari kontrol yang sehat secara kognitif. 5 , 11 , 12 Biomarker darah lainnya, termasuk amiloid β-40 (Aβ40), glial fibrillary acids protein (GFAP), dan neurofilament light (NfL), yang diubah pada pasien AD, juga telah menunjukkan potensi dalam diagnosis AD. 13 – 16 Konferensi Internasional Asosiasi Alzheimer (AAIC) merevisi pedoman diagnostik AD pada Oktober 2023, merekomendasikan penggunaan neuro-marker darah sebagai biomarker diagnostik inti melalui uji plasma yang akurat selama tahap awal AD. 17 Rekomendasi tersebut mencakup biomarker AD inti Aβ42, Aβ40, Aβ42/Aβ40, dan p-tau181 serta biomarker non-spesifik NfL dan GFAP. Pedoman ini menginformasikan pilihan biomarker untuk penelitian ini. Lebih jauh, Badan Pengawas Obat dan Makanan AS telah menyetujui Leqembi untuk pengobatan AD, 18 menjadikannya obat AD pertama yang disetujui FDA. Persetujuan ini menggarisbawahi semakin pentingnya diagnosis AD yang akurat. Akibatnya, skrining biomarker darah skala besar untuk AD menjadi semakin layak.
Namun, perhatian terbatas telah diberikan pada diagnosis AD pada individu berusia 75 tahun ke atas, dengan usia rata-rata sebagian besar kelompok studi saat ini di bawah usia ini. 4 , 19 – 21 Populasi individu yang lebih tua meningkat, dengan harapan hidup rata-rata di kota-kota Cina yang sangat maju, seperti Shanghai dan Beijing, melampaui 80 tahun. Di Hong Kong, bahkan telah melampaui 85 tahun. Demografi yang berkembang ini menyoroti perlunya untuk mengeksplorasi penerapan neuro-marker untuk diagnosis AD pada populasi setengah baya dan tertua, karena kelompok usia ini sering kurang terwakili dalam penelitian neurodegeneratif, meskipun mereka berisiko paling besar untuk AD. Degenerasi otak dan neuronal yang berkaitan dengan usia membuat sulit untuk membedakan apakah penurunan kognitif merupakan hasil dari penuaan normal atau masalah patologis yang mendasarinya seperti AD. Selain itu, variasi yang signifikan dalam fungsi kognitif dan kesehatan fisik karena faktor-faktor seperti komorbiditas (termasuk gangguan neurologis, kardiovaskular, dan metabolik) dapat memengaruhi patogenesis AD dan kadar neuro-marker plasma, sehingga mempersulit diagnosis. Metode diagnostik yang andal dan non-invasif sangat penting bagi kelompok lanjut usia, karena prosedur invasif dan teknik pencitraan yang mahal mungkin tidak memungkinkan. Oleh karena itu, penting untuk menentukan apakah penambahan biomarker tertentu, seperti p-tau181 dan NfL, dapat meningkatkan akurasi skrining dan diagnosis AD pada kelompok usia ini, karena diagnosis dini dan akurat dapat memungkinkan intervensi tepat waktu, meningkatkan manajemen perawatan, dan memberikan dukungan yang lebih baik bagi pasien dan keluarga untuk perencanaan dan pengambilan keputusan di masa mendatang.
Penelitian ini memiliki dua tujuan utama. Pertama, kami bertujuan untuk mengevaluasi kemanjuran penanda saraf plasma dalam skrining AD di antara pasien lanjut usia dengan komorbiditas kompleks termasuk gangguan neurologis, kardiovaskular, dan metabolik. Kedua, dengan membangun berbagai model diagnostik, kami berusaha untuk menunjukkan potensi penerapan skrining penanda saraf berbasis darah untuk AD dalam demografi khusus ini.
2 METODE DAN BAHAN
2.1 Desain penelitian dan partisipan
Studi ini disetujui oleh Komite Etik Medis Rumah Sakit Umum Shanghai, Sekolah Kedokteran Universitas Shanghai Jiao Tong, Shanghai, Tiongkok (nomor [2025] 044) dan terdaftar di Registri Uji Klinis Tiongkok (ChiCTR2500097057). Studi ini melibatkan pasien rawat inap dari departemen geriatri Rumah Sakit Umum Shanghai, yang berafiliasi dengan Universitas Shanghai Jiao Tong dari September 2021 hingga Februari 2022. Kriteria inklusi adalah sebagai berikut: (1) Usia ≥ 75 tahun dengan formulir persetujuan yang diinformasikan. (2) Menyelesaikan semua tes darah dan penilaian neuropsikologis yang disyaratkan. Kriteria eksklusi adalah sebagai berikut: (1) Pasien dengan gangguan kesadaran. (2) Pasien dalam tahap akut infark serebral, pendarahan otak, infark miokard, dan infeksi berat. (3) Pasien dengan kebutaan, ketulian, atau gangguan mental berat lainnya memengaruhi hasil penilaian kognitif.
Proses rekrutmen partisipan untuk penelitian ini diilustrasikan dalam Gambar 1. Sebanyak 239 pasien rawat inap awalnya dipertimbangkan untuk penelitian ini, dengan 131 dikecualikan menurut kriteria yang relevan atau karena tidak bersedia berpartisipasi. Akhirnya, 108 partisipan diikutsertakan dan dikategorikan ke dalam tiga kelompok: AD, non-demensia, dan non-AD. Kelompok non-AD terdiri dari partisipan yang tidak memiliki diagnosis AD, termasuk partisipan demensia non-demensia dan non-AD.
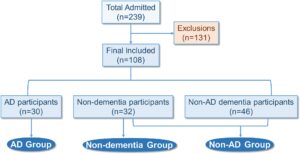
Penilaian kognitif dan diagnosis AD dilakukan oleh ahli saraf dan ahli saraf bersertifikat. Demensia diidentifikasi berdasarkan Mini-Mental State Examination (MMSE), dengan titik batas disesuaikan dengan tingkat pendidikan (kurang dari 6 tahun: ≤17, 6–8 tahun: ≤20, 9–11 tahun: ≤22, 12 tahun atau lebih: ≤24). AD didiagnosis secara klinis menurut kriteria NINCDS-ADRDA, 22 yang meliputi: (1) demensia dikonfirmasi melalui pemeriksaan klinis dan tes neuropsikologis; (2) gangguan pada setidaknya dua domain kognitif; (3) tidak adanya gangguan kesadaran; (4) onset antara usia 40 dan 90 tahun; (5) gangguan aktivitas kehidupan sehari-hari dan perubahan perilaku; dan (6) pengecualian gangguan lain yang dapat menjelaskan penurunan memori dan kognitif. Untuk kelompok non-demensia, status dikonfirmasi melalui skor MMSE dalam kisaran normal untuk usia dan tingkat pendidikan mereka; peserta dikeluarkan dari kelompok ini jika ada tanda atau gejala klinis yang menunjukkan demensia atau gangguan neurologis terkait.
2.2 Karakteristik demografi dan data klinis
Karakteristik demografi (Tabel 1 ) dikumpulkan dari peserta dan/atau proksi melalui kuesioner, dengan komorbiditas diverifikasi menggunakan catatan medis. Indikator biokimia tambahan dianalisis menggunakan metode berikut. Sel darah putih (WBC), sel mononuklear, dan hemoglobin (Hb) diukur melalui analisis hematologi (XN-9100, SYSMEX, Tokyo, Jepang). Cystatin C (Cys-C), albumin (Alb), alanine aminotransferase (ALT), aspartate transaminase (AST), homocysteine (Hcy), apolipoprotein E (ApoE), dan D-Dimer dianalisis melalui analisis biokimia (AU5800, BECKMAN, CA, AS). Protein C-reaktif (CRP) dan hemoglobin terglikosilasi (HbA1c) dinilai dengan nefelometri imunohamburan lateks (CS-7500, Mindray, Tiongkok) dan kromatografi cair kinerja tinggi (Adams A1c HA-8180, Arkray, Kyoto, Jepang). Vitamin B12 (VB12), asam folat, serum amiloid A (SAA), hormon perangsang tiroid (TSH), dan peptida natriuretik otak (BNP) ditentukan melalui uji imun (DXI800, BECKMAN, CA, AS). Laju filtrasi glomerulus yang diperkirakan (eGFR, CKD-EPI2009scr) dihitung berdasarkan kreatinin serum (Scr):
| Karakteristik | Jumlah ( n = 108) | Non-demensia a ( n = 32) | Bukan AD b ( n = 78) | IKLAN ( n = 30) | nilai p (non-demensia vs. AD) | nilai p (non-AD vs. AD) |
|---|---|---|---|---|---|---|
| Usia, tahun | 92,0 ± 5,8 | 88,2 ± 6,2 | 91,4 ± 6,2 | 93,8 ± 4,4 | <0,001 | 0,048 tahun |
| Laki-laki, tidak. | 87 (80,6%) | 26 (81,3%) | 67 (85,9%) | 20 (66,7%) | 0,255 | 0,024 |
| Pendidikan, tahun | 13,8 ± 3,0 | 14,1 ± 2,8 | 14,0 ± 2,8 | 13,4 ± 3,4 | 0.407 | 0,315 |
| Tes MMSE | 13 (0–24) | 26 (25–27) | 18 (4–25) | 0 (0–6) | <0,001 | <0,001 |
| Diabetes, tidak. | 54 (50,0%) | 17 (53,1%) | 42 (53,8%) | 12 (40,0%) | 0.309 | 0.197 |
| Hipertensi, tidak. | 82 (75,9%) | 29 (90,6%) | 63 (80,8%) | 19 (63,3%) | 0,016 | 0,058 |
| CHD, tidak. | 65 (60,2%) | 20 (62,5%) | 48 (61,5%) | 17 (56,7%) | 0.605 | 0.643 |
| Stroke, tidak. | 40 (37,0%) | 5 (15,6%) | 27 (34,6%) | 13 (43,3%) | 0,026 | 0.401 |
| AF, tidak. | 27 (25,0%) | 4 (12,5%) | 21 (26,9%) | 6 (20,0%) | 0,508 tahun | 0.457 |
| EP, tidak. | 5 (4,6%) | 0 (0%) | 2 (2,6%) | 3 (10,0%) | 0.113 | 0.100 |
| PD, tidak. | 5 (4,6%) | 0 (0%) | 5 (6,4%) | 0 (0,0%) | 1.000 | 0.319 |
| Tumor ganas, tidak. | 30 (27,8%) | 7 (21,9%) | 25 (32,1%) | 5 (16,7%) | 0.749 | 0.110 |
| Cys-C, mg/L | 1.7 (1.3–2.3) | 1.3 (1.2–2.0) | 1.7 (1.3–2.2) | 1.7 (1.3–2.6) | 0,042 tahun | 0.424 |
| Ckd-epi2009scr, ml/menit/1,73 m2 | 63,8 ± 21,8 | 63,8 ± 20,7 | 63,8 ± 21,9 | 63,8 ± 21,7 | 0,937 tahun | 0,996 tahun |
| Alb, g/L | 32,8 ± 4,0 | 34,9 ± 3,2 | 33,2 ± 4,07 | 31,9 ± 3,8 | 0,002 | 0.128 |
| Sel darah putih, ×109 / L | 6.3 (5.3–7.5) | 5.9 (5.0–6.9) | 6.3 (5.3–7.5) | 6.3 (5.2–7.9) | 0.204 | 0.921 |
| Sel mononuklear ×109 / L | 0,5 (0,4–0,6) | 0,4 (0,4–0,5) | 0,5 (0,4–0,6) | 0,44 (0,37–0,57) | 0,977 tahun | 0.784 |
| ALT, U/L | 12.9 (8.1–18.9) | 14.2 (10.9–18.2) | 13.4 (9.3–19.3) | 10.8 (6.6–17.2) | 0,053 | 0,057 tahun |
| AST, U/L | 20,6 (16,5–24,6) | 20.3 (17.0–24.4) | 21,5 (16,5–26,9) | 19.1 (15.0–22.3) | 0.356 | 0.124 |
| Konsentrasi EPA, mg/L | 51,0 (44,9–59,8) | 48,4 (42,1–55,8) | 49,4 (44,6–59,7) | 54,0 (48,3–63,4) | 0,056 tahun | 0.120 |
| Hb, gram/L | 114,2 ± 19,4 | 125,1 ± 14,1 | 115,9 ± 19,0 | 109,7 ± 20,0 | 0,001 | 0.142 |
| Kadar CRP, mg/L | 3.1 (1.2–10.3) | 2.2 (0,9–8,7) | 2.2 (0,9–8,7) | 6,5 (1,6–17,4) | <0,001 | 0,010 |
| HbA1c, % | 5.8 (5.4–6.6) | 5.9 (5.6–6.9) | 5.9 (5.4–6.7) | 5.7 (5.4–6.6) | 0,147 tahun | 0.397 |
| VB12, pg/L | 424,5 (271,0–642,0) | 387 (251–673) | 449,0 (329,0–635,0) | 342,0 (264,0–649,0) | 0,676 tahun | 0,167 |
| Asam folat, pg/L | 12,7 (6,8–23,6) | 10.1 (6.7–16.5) | 12.3 (6.8–22.8) | 14.1 (6.7–24.0) | 0.298 | 0.662 |
| Hcy, μmol/L | 11.4 (8.4–16.5) | 10.9 (8.0–14.5) | 11.4 (8.4–16.4) | 11.7 (7.9–17.0) | 0,655 tahun | 0,997 tahun |
| Kandungan Asam Asetat (SAA), mg/L | 16,6 (8,2–56,4) | 8.7 (5.1–17.0) | 15.8 (7.1–47.2) | 19.1 (10.6–111.8) | 0,002 | 0.104 |
| TSH, μIU/ml | 2.6 (1.8–4.0) | Bahasa Inggris: 3.0 (2.1–4.1) | 2.8 (1.9–4.1) | 2.2 (1,5–3,5) | 0,044 tahun | 0,045 pukul 0,045 |
| D-Dimer, mg/L | 1.0 (0,6–1,9) | 0,9 (0,5–2,0) | 1.1 (0,6–1,9) | 1.0 (0,7–2,1) | 0.254 | 0.824 |
| BNP, pg/ml | 97,0 (57,0–214,5) | 78,0 (50,5–133,5) | 101 (56–183) | 90,0 (58,0–301,0) | 0.226 | 0.636 |
Catatan : Variabel biner direpresentasikan sebagai angka (persentase). Variabel kontinu dianalisis untuk mengetahui kenormalannya. Untuk variabel kontinu yang terdistribusi normal, rata-rata ± simpangan baku dilaporkan, dan perbedaan antar kelompok dianalisis menggunakan uji- t . Untuk variabel kontinu yang tidak terdistribusi normal, median (rentang interkuartil) disajikan. Perbedaan antar kelompok dinilai menggunakan uji Wilcoxon rank-sum. Uji Pearson chi-square dan Fisher exact digunakan untuk variabel kategoris. Singkatan: AD, penyakit Alzheimer; Alb, albumin; ALT, alanine aminotransferase; ApoE, apolipoprotein E; AST, aspartat transaminase; BNP, peptida natriuretik otak; CRP, protein C-reaktif; Cys-C, Cystatin C; Hb, hemoglobin; HbA1c, hemoglobin glikosilasi; Hcy, homosistein; MMSE, pemeriksaan status mental mini; SAA, serum amiloid A; TSH, hormon perangsang tiroid; VB12, Vitamin B12; WBC, sel darah putih. a Kelompok non-demensia mencakup peserta tanpa demensia. b Kelompok non-AD mencakup demensia non-AD (termasuk penyakit Parkinson, demensia vaskular, dan subtipe demensia lain yang tidak terklasifikasi) dan peserta non-demensia.

2.3 Pengumpulan plasma dan pengukuran biomarker
Sampel darah dikumpulkan ke dalam tabung berlapis asam etilen diamina tetraasetat (EDTA) (Tabung Pengumpul Darah Vacutainer, K3 EDTA, Becton Dickinson, Eysins, Swiss) dan segera disentrifugasi pada 1000 rpm selama 15 menit pada suhu 4°C. Setelah disentrifugasi, sampel plasma dibagi dan disimpan pada suhu -80°C hingga dilakukan analisis.
Kadar Aβ40, Aβ42, GFAP, NfL, dan p-tau181 dalam sampel plasma diukur menggunakan platform SiMoA (Quanterix, MA, AS) dengan Neuro 4-Plex E Kits (Nomor Katalog 103670) dan p-tau181 Advantage V2 Kit (Nomor Katalog 103714) sesuai dengan petunjuk pabrik pembuat. Penguji tidak mengetahui informasi sampel untuk menghindari bias dan memastikan hasil yang objektif. Kontrol kualitas dalam kit diuji dua kali dengan koefisien variasi (CV) kurang dari 10% untuk memastikan konsistensi pengujian.
2.4 Analisis statistik
Rata-rata dan simpangan baku (SD) digunakan untuk menggambarkan variabel kontinu yang berdistribusi normal, sedangkan median dan kuartil (Q1 hingga Q3) digunakan untuk variabel kontinu yang miring. Variabel kategoris diringkas menggunakan frekuensi ( n ) dan persentase (%). Uji- t dan uji Wilcoxon rank-sum digunakan untuk membandingkan perbedaan antara kelompok untuk variabel kontinu yang berdistribusi normal dan variabel kontinu yang berdistribusi tidak normal, masing-masing, sedangkan uji chi-kuadrat Pearson dan uji eksak Fisher digunakan untuk variabel kategoris. Statistik deskriptif digunakan untuk meringkas karakteristik populasi studi. Boxplot dibuat menggunakan Origin 2021 (OriginLab), dan signifikansi statistik antara kelompok dinilai menggunakan uji Mann–Whitney U untuk perbandingan non-parametrik. Koefisien korelasi Spearman digunakan untuk menilai hubungan antara enam neuro-marker dan faktor-faktor lainnya. Kekuatan korelasi dikategorikan sebagai buruk ( r < 0,2), cukup ( r = 0,2–0,4), cukup kuat ( r = 0,4–0,7), dan kuat ( r > 0,7). Analisis regresi logistik biner univariat digunakan untuk mengevaluasi hubungan kondisi fisiologis (misalnya, fungsi ginjal yang dinilai dengan eGFR, penanda inflamasi seperti CRP, hipertensi, dan diabetes), dengan hasil yang dianalisis adalah ada atau tidaknya AD, yang didefinisikan sebagai variabel biner (AD: ya/tidak). Signifikansi statistik ditetapkan pada p < 0,05. Area di bawah kurva (AUC) dihitung menggunakan metode integrasi numerik yang memperkirakan area di bawah kurva dengan menjumlahkan area trapesium yang terbentuk di antara titik data.
2.5 Pengembangan model
Semua analisis statistik dilakukan menggunakan IBM SPSS Statistics 26 dan Origin 2017. Untuk mengevaluasi kinerja deteksi setiap biomarker plasma, set protein komposit, dan model diagnostik, kami menggunakan regresi logistik biner.
Untuk membangun model yang disederhanakan, regresi logistik biner dengan metode kondisional mundur digunakan untuk menentukan kombinasi biomarker plasma dan karakteristik demografi yang paling sesuai. Untuk lebih meningkatkan kinerja deteksi, analisis regresi logistik biner univariat dilakukan untuk menilai hubungan indikator klinis tambahan dan komorbiditas dengan diferensiasi antara kelompok AD dan non-AD. Selama analisis ini, tingkat signifikansi p < 0,1 diadopsi untuk memastikan bahwa prediktor yang berpotensi relevan tidak dikecualikan sebelum waktunya.
3 HASIL
3.1 Karakteristik peserta
Kohort terdiri dari 108 peserta, termasuk 30 pasien AD (kelompok AD). Dari 78 peserta non-AD (kelompok non-AD), 32 adalah peserta tanpa demensia (kelompok non-demensia), dan 46 didiagnosis dengan demensia yang tidak disebabkan oleh AD. Karakteristik dasar ditunjukkan pada Tabel 1 ; kelompok non-AD berbeda secara signifikan dari kelompok AD dalam hal usia ( p = 0,048), CRP ( p = 0,010), dan kadar TSH ( p = 0,045). Kelompok non-demensia menunjukkan perbedaan yang signifikan dari kelompok AD dalam tiga parameter ini dan juga dalam stroke ( p = 0,048), hipertensi ( p = 0,048), SAA ( p = 0,048), Hb ( p = 0,048), Alb ( p = 0,048), dan Cys-C ( p = 0,048).
3.2 Perbandingan konsentrasi neuro-biomarker plasma
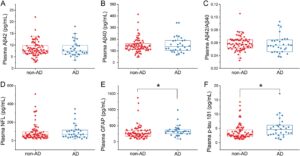
Seperti yang ditunjukkan pada Gambar 2 , nilai median semua neuro-marker, kecuali rasio Aβ42/Aβ40, lebih tinggi pada kelompok AD dibandingkan dengan kelompok non-demensia; perbedaan dalam NfL, GFAP, dan p-tau181 secara statistik signifikan [median (rentang interkuartil): 68,62 (39,78–113,11) pg/mL, 319,32 (252,51–383,45) pg/mL, dan 4,35 (2,85–6,06) pg/mL dibandingkan dengan 45,87 (30,88–67,52) pg/mL, 216,69 (117,91–267,59) pg/mL, dan 2,27 (1,95–2,84) pg/mL, masing-masing; p = 0,0046, 0,00011, dan 0,000095]. Gambar 3 menunjukkan bahwa hanya GFAP dan p-tau181 yang memiliki konsentrasi yang jauh lebih tinggi pada kelompok AD [321,40 (249,70–384,28) pg/mL dan 4,57 (2,85–6,06) pg/mL] dibandingkan dengan kelompok non-AD yang berisi pasien dengan gangguan kognitif lainnya [247,28 (171,21–351,62) pg/mL dan 2,82 (2,13–4,45) pg/mL] dengan nilai p masing-masing 0,017 dan 0,011. Penanda Aβ tidak menunjukkan perbedaan yang signifikan.

3.3 Faktor Relatif Neuro-Marker Plasma
Gambar 4 menunjukkan bahwa beberapa fungsi dan kondisi fisik dikaitkan secara signifikan dengan neuro-marker plasma. Secara khusus, NfL berkorelasi positif dengan Cys-C ( r = 0,60), D-Dimer ( r = 0,52), dan CRP ( r = 0,42), dan berkorelasi negatif dengan MMSE ( r = -0,48), CKD-EPI2009scr ( r = -0,42), Alb ( r = -0,46), dan Hb ( r = -0,56). Aβ42 menunjukkan korelasi positif dengan Cys-C ( r = 0,71) dan Hcy ( r = 0,42), dan korelasi negatif dengan CKD-EPI2009scr ( r = -0,65) dan Hb ( r = -0,49). Aβ40 memiliki korelasi terbalik sedang dengan CKD-EPI2009scr ( r = −0,61) dan Hb ( r = −0,51), dan korelasi positif dengan Cys-C ( r = 0,73), Hcy ( r = 0,41), dan BNP ( r = 0,42). Rasio Aβ42/Aβ40 berkorelasi buruk atau tidak signifikan dengan indikator lainnya. GFAP memiliki korelasi negatif sedang dengan MMSE ( r = −0,49). Kadar p-tau181 yang lebih tinggi berkorelasi sedang dengan MMSE yang lebih buruk ( r = −0,46), Hb yang lebih rendah ( r = −0,50), dan Cys-C yang lebih tinggi ( r = 0,57), CRP ( r = 0,47), dan Hcy ( r = 0,45). Selain itu, usia, stroke, dan SAA juga menunjukkan korelasi sedang dengan sebagian besar penanda saraf.

3.4 Kinerja diagnostik biomarker plasma
Seperti yang ditunjukkan pada Gambar 5A , kinerja diagnostik meningkat secara progresif dengan dimasukkannya biomarker tambahan, seperti yang ditunjukkan dengan meningkatnya nilai AUC. Di antara biomarker protein tunggal, p-tau181 dan GFAP menunjukkan daya diagnostik tertinggi, dengan AUC masing-masing sebesar 0,7731 (interval kepercayaan 95% (CI), 0,6493–0,8969) dan 0,7659 (95% CI, 0,6424–0,8882). Ini diikuti oleh NfL, Aβ40, Aβ42, dan rasio Aβ42/Aβ40 dalam urutan daya diagnostik yang menurun. Penambahan karakteristik demografi meningkatkan AUC Model Diagnostik Komprehensif 1 menjadi 0,8988 (95% CI, 0,8189–0,9786), dengan sensitivitas 82,8% dan spesifisitas 87,1%. Selain itu, Model Sederhana 1, yang hanya mencakup tiga biomarker dan informasi demografi (p-tau181, GFAP, dan usia), juga menunjukkan kinerja diagnostik yang sebanding, dengan AUC 0,8654 (95% CI, 0,7762–0,9546), sensitivitas 75,9%, dan spesifisitas 80,6%.
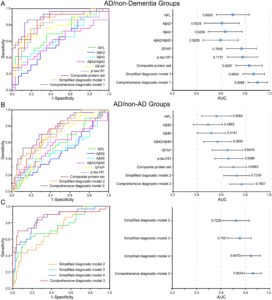
Namun, mengingat prevalensi substansial dari gangguan kognitif di antara populasi yang lebih tua, membedakan pasien AD dari individu yang lebih tua dengan penyebab lain dari kelainan kognitif tetap menjadi tantangan klinis yang kritis. Kami selanjutnya menyempurnakan kelompok non-AD untuk menyertakan peserta tanpa demensia serta individu dengan bentuk lain dari demensia non-AD. Seperti yang ditunjukkan pada Gambar 5B , p-tau181 dan GFAP terus menunjukkan kinerja diagnostik terbaik di antara enam neuro-marker, dengan AUC masing-masing sebesar 0,6586 (95% CI, 0,5418–0,7753) dan 0,6479 (95% CI, 0,5225–0,7732). Penambahan karakteristik demografi meningkatkan AUC dari Model Komprehensif 2, yang mencakup enam biomarker plasma dan tiga karakteristik demografi, menjadi 0,7607 (95% CI, 0,6611–0,8603), yang menunjukkan kinerja diagnostik terbaik dengan sensitivitas 33,3% dan spesifisitas 93,6%. Model Sederhana 2, yang menggabungkan p-tau181, NfL, dan faktor demografi seperti usia dan jenis kelamin, menyederhanakan analisis sambil mempertahankan kinerja deteksi (AUC 0,7239 [95% CI, 0,6159–0,8320], sensitivitas 26,7%, dan spesifisitas 93,6%). Namun, tingkat diagnostik untuk pasien AD tetap suboptimal.
3.5 Optimasi model untuk diagnosis
Meskipun neuro-marker plasma menunjukkan kinerja diagnostik yang baik dalam membedakan AD dari individu tanpa demensia, kemanjurannya dalam membedakan peserta AD dari non-AD kurang mengesankan. Analisis regresi logistik biner univariat dilakukan untuk menilai hubungan indikator dan komorbiditas lain dengan diferensiasi AD/non-AD. Seperti yang ditunjukkan dalam Tabel 2 , hanya BNP dan hipertensi yang memiliki nilai- p kurang dari 0,1 (masing-masing 0,075 dan 0,062). Menggabungkan BNP dan hipertensi ke dalam Model Sederhana 2 (menghasilkan Model Sederhana 3, Gambar 5C ) meningkatkan AUC dari 0,7239 menjadi 0,7551, dengan sensitivitas 40,0% dan spesifisitas 94,9%. Variabel-variabel ini membahas berbagai aspek patogenesis AD—indikator risiko eksternal, proses neuroinflamasi, dan faktor kardiovaskular. AUC model 4 yang disederhanakan, yang selanjutnya menggabungkan MMSE, meningkat menjadi 0,8470 dengan sensitivitas dan spesifisitas masing-masing sebesar 56,7% dan 89,7%. Model 3 yang komprehensif, yang mencakup enam biomarker protein, tiga karakteristik demografi, BNP, hipertensi, dan MMSE, mencapai AUC sebesar 0,8624 (IK 95%, 0,7921–0,9327) dengan sensitivitas 50,0% dan spesifisitas 96,2%.
| Variabel | Analisis univariat | ||
|---|---|---|---|
| Logistik (OR) | 95% CI | nilai p | |
| Cys-C | 0.272 | ±0,255 | 0.287 |
| Ckd-epi2009scr | <0,001 | ±0,01 | 0,996 tahun |
| Bahasa Inggris | -0,083 | ±0,054 tahun | 0.129 |
| sel darah putih | 0,027 | ±0,089 | 0.756 |
| Sel mononuklear | 0,580 | ±0,568 | 0.307 |
| ALT | -0,027 | ±0,021 | 0.207 |
| Bahasa Inggris | -0,049 | ±0,030 | 0,108 |
| ApoE | 0,014 tahun | ±0,014 detik | 0,337 tahun |
| Hb | -0,016 | ±0,011 | 0.143 |
| Bahasa Indonesia: CRP | 0,003 | ±0,006 detik | 0,597 tahun |
| HbA1c | -0,264 | ±0,227 | 0,245 |
| Bahasa Inggris VB12 | -0,001 | ±0,001 detik | 0.107 |
| Asam folat | 0,017 tahun | ±0,028 | 0.553 |
| Hcy | 0,012 | ±0,028 | 0.670 |
| Bahasa Indonesia: SAA | <0,001 | Tidak ada komentar: | 0,598 |
| TSH | -0,165 | ±0,143 | 0.247 |
| D-Dimer | <0,001 | ±0,064 detik | 0,993 tahun |
| BNP | 0,002 | ±0,001 detik | 0,075 hari |
| Hipertensi | -0,889 | ±0,475 detik | 0,062 |
| Diabetes | -0,560 | ±0,436 | 0.200 |
| Penyakit Jantung Koroner (PJK) | -0,202 | ±0,436 | 0.643 |
| Stroke | 0,368 tahun | ±0,439 | 0.402 |
| SETELAH | -0,388 | ±0,523 | 0.458 |
| Bahasa Inggris | 1.440 | ±0,940 | 0,125 |
| PD | -0,686 | ±1.117 | 0,539 |
| Tumor ganas | -0,858 | ±0,547 tahun | 0.116 |
Singkatan: Alb, albumin; ALT, alanine aminotransferase; ApoE, apolipoprotein E; AST, aspartate transaminase; BNP, brain natriuretic peptide; CI, confidence interval; CRP, C-reactive protein; Cys-C, Cystatin C; Hb, hemoglobin; HbA1c, hemoglobin glikosilasi; Hcy, homosistein; SAA, serum amiloid A; TSH, thyroid-stimulating hormone; VB12, Vitamin B12; WBC, sel darah putih.
4 DISKUSI
Singkatnya, hasil kami menunjukkan bahwa neuro-marker plasma, termasuk p-tau181 dan GFAP, meningkat secara signifikan pada individu dengan AD dibandingkan dengan kelompok non-demensia dan non-AD, dan penanda ini menunjukkan kinerja diagnostik yang baik untuk AD. Namun, beberapa fungsi dan kondisi fisik dikaitkan secara signifikan dengan neuro-marker plasma. Penambahan hipertensi dan BNP ke model diagnostik membantu meningkatkan daya diskriminatifnya. Temuan ini menunjukkan bahwa menggabungkan beberapa neuro-marker plasma dan indikator fisik dapat meningkatkan akurasi diagnosis AD, terutama untuk populasi yang tidak dapat menjalani prosedur diagnostik invasif.
Populasi penelitian terdiri dari sekelompok pasien rawat inap tertua dengan usia rata-rata 92 tahun, termasuk delapan orang berusia seratus tahun. Dengan menganalisis sampel plasma dan mengumpulkan informasi klinis dari para peserta, kami bertujuan untuk mengevaluasi potensi diagnostik biomarker berbasis darah untuk diagnosis AD pada kelompok usia lanjut ini dengan komorbiditas yang kompleks.
Penggunaan metode deteksi yang sangat sensitif memungkinkan analisis yang tepat terhadap neuromarker plasma yang jumlahnya sedikit. Pendekatan ini memberikan akurasi diagnostik yang lebih baik. Selain itu, pendekatan ini menghindari masalah kepatuhan pasien yang rendah yang terkait dengan pengambilan sampel CSF tradisional dan pencitraan PET.
Studi kami menggabungkan enam biomarker plasma, termasuk biomarker AD inti Aβ42, Aβ40, rasio Aβ42/Aβ40, dan p-tau181, serta biomarker non-spesifik NfL dan GFAP. 17 Di antara ini, hanya GFAP dan p-tau181 yang menunjukkan peningkatan signifikan pada pasien AD, yang menunjukkan potensi mereka untuk membedakan pasien AD dari rekan-rekan mereka yang non-demensia dan non-AD pada populasi yang lebih tua. Perbandingan antara kelompok AD dan non-demensia tidak menunjukkan perbedaan signifikan dalam nilai penanda Aβ. Temuan-temuan ini, bersama dengan studi-studi sebelumnya, 23 , 24 menunjukkan bahwa penanda terkait Aβ mungkin lebih cocok untuk deteksi dini AD daripada pada individu yang lebih tua. Studi skala besar dan penelitian longitudinal diperlukan untuk memvalidasi pengamatan ini dan untuk mengeksplorasi utilitas penanda terkait Aβ dalam kelompok usia yang berbeda. Kadar plasma Aβ42 dan Aβ40 dipengaruhi oleh usia, penyakit penyerta, fungsi organ, tingkat peradangan, dan status gizi, khususnya fungsi ginjal. 25 Oleh karena itu, memasukkan individu dengan usia lanjut dan berbagai penyakit penyerta dalam kelompok studi kami dapat memengaruhi kadar neuro-marker plasma di berbagai kelompok, sehingga mempersulit penggunaan penanda ini untuk identifikasi AD. Temuan ini menggarisbawahi perlunya mengidentifikasi neuro-marker darah yang lebih sesuai untuk skrining individu yang lebih tua.
Namun, dalam pengaturan dunia nyata, kadar neuro-marker plasma ini dapat dipengaruhi oleh kondisi fisiologis lainnya. Memahami pengaruh ini sangat penting untuk menggabungkan dampak kondisi kesehatan yang mendasarinya saat membangun model diagnostik; pemahaman tersebut akan meningkatkan penerapan dan keandalan model ini dalam praktik klinis. Oleh karena itu, kami mengumpulkan data mengenai kondisi fisiologis lain dari subjek dan menemukan hubungan antara stroke dan berbagai penanda. Penelitian sebelumnya 26 telah mengamati peningkatan kadar NfL dan GFAP setelah stroke. Namun, relatif sedikit yang melaporkan korelasi antara riwayat stroke dan Aβ42, Aβ40, Aβ42/Aβ40, dan p-tau181, terutama pada pasien yang lebih tua. Sebuah penelitian yang melibatkan individu Kaukasia 27 menghubungkan kadar NfL plasma yang lebih tinggi dengan riwayat stroke, sementara tidak ada hubungan yang ditemukan untuk Aβ42, Aβ40, Aβ42/Aβ40, dan tau total. Studi berbasis komunitas lain yang melibatkan individu kulit putih dan kulit hitam 28 melaporkan riwayat stroke dikaitkan dengan konsentrasi plasma p-tau181 yang lebih tinggi. Dalam hasil kami, riwayat stroke menunjukkan korelasi positif dengan kadar plasma NfL, Aβ42, Aβ40, GFAP, dan p-tau181; perbedaan dalam hasil ini berpotensi disebabkan oleh latar belakang ras dan distribusi usia yang beragam dari berbagai populasi studi.
Kumpulan indeks darah yang terkait dengan fungsi organ, tingkat peradangan, status gizi, dan aspek terkait lainnya dilakukan untuk menyelidiki potensi hubungan antara penanda saraf plasma dan fungsi tubuh.
Dalam hal organ, indikator fungsi jantung, hati, dan ginjal dipertimbangkan. Sekarang diterima secara luas bahwa faktor risiko kardiovaskuler dan serebrovaskular secara signifikan meningkatkan kemungkinan mengembangkan AD. 29 , 30 Hcy, asam amino eksitatori, 31 telah digunakan untuk mengkarakterisasi hiperhomosisteinemia, faktor risiko independen untuk penyakit kardiovaskular dan serebrovaskular. Hiperhomosisteinemia telah dikaitkan dengan mikroangiopati serebral, 32 disfungsi endotel, 33 gangguan aktivitas oksida nitrat, 34 dan peningkatan stres oksidatif, 35 yang semuanya terkait dengan penuaan otak. 35 Sebuah studi observasional prospektif menunjukkan hubungan yang signifikan dan progresif antara konsentrasi plasma Hcy secara keseluruhan dan kemungkinan mengembangkan demensia dan AD. Secara khusus, peningkatan 5 μM dalam tingkat plasma Hcy ditemukan meningkatkan risiko AD hingga 40%. 36 Tingkat plasma Hcy dapat dikurangi dengan suplementasi asam folat. 37 Dalam penelitian kami, kami menemukan bahwa konsentrasi Hcy dan asam folat dalam darah menunjukkan korelasi dengan beberapa neuro-marker plasma, yang menunjukkan hubungan potensial antara Hcy, asam folat, dan neurodegenerasi, bahkan pada tahap penuaan lanjut. Berdasarkan temuan awal ini, penyelidikan lebih lanjut diperlukan untuk menentukan apakah suplementasi asam folat tambahan dapat meningkatkan hasil kognitif pada individu yang lebih tua. Selain hiperhomosisteinemia, gagal jantung kronis, yang dievaluasi oleh BNP dan NT-proBNP (peptida natriuretik tipe B pro terminal-N) dalam praktik klinis, juga telah dikaitkan dengan peningkatan kerentanan terhadap AD. 29 , 30 Gagal jantung merupakan konsekuensi yang umum dan parah dari berbagai kondisi jantung dan dikaitkan dengan prognosis yang buruk. 38 Analisis post hoc pasien dengan gagal jantung stabil kronis 38 mengungkapkan bahwa konsentrasi NfL dan p-tau181 yang lebih tinggi dikaitkan dengan usia yang lebih tua dan kadar NT-proBNP yang lebih tinggi. Dalam penelitian kami, kadar BNP yang lebih tinggi juga ditemukan terkait dengan peningkatan NfL, p-tau181, Aβ42, dan Aβ40. Temuan ini menunjukkan bahwa gagal jantung kronis dapat menyebabkan kerusakan neuron, dan indikator BNP yang terkait dengan gagal jantung harus dipertimbangkan saat mempertimbangkan aplikasi klinis penanda saraf NfL dan p-tau181.
Indikator fisiologis yang berhubungan dengan fungsi ginjal, yaitu Cys-C dan CKD-EPI2009scr, berkorelasi signifikan dengan NfL plasma, Aβ42, Aβ40, dan p-tau181, sementara Cys-C juga berkorelasi dengan GFAP plasma, konsisten dengan temuan dari penyelidikan sebelumnya. 39 – 42 Peningkatan biomarker plasma mungkin disebabkan oleh permeabilitas BBB yang terganggu, yang berpotensi disebabkan oleh toksin uremik yang terikat protein 39 dan komplikasi lain yang timbul akibat gagal ginjal, seperti hipoalbuminemia dan anemia.
Dalam hal status gizi, hipoalbuminemia dan anemia telah diketahui sebagai faktor yang berpengaruh dalam perkembangan AD. Kadar albumin yang rendah di otak dan CSF dapat menyebabkan peningkatan patologi AD, 43 sementara pasien dengan anemia dilaporkan memiliki peningkatan risiko terkena AD. 24 Peningkatan risiko demensia pada pasien anemia mungkin merupakan akibat dari hipoksia otak kronis yang terkait dengan anemia, serta penurunan kadar eritropoietin, yang dapat meningkatkan risiko kehilangan neuron. Dalam penelitian kami, kami mengamati korelasi signifikan antara kadar plasma NfL, Aβ40, dan p-tau181 dengan albumin darah, serta kadar plasma NfL, Aβ42, Aβ40, GFAP, dan p-tau181 dengan Hb darah. Temuan ini memerlukan penyelidikan lebih lanjut; mungkin ada manfaat untuk lebih memperhatikan pengobatan pasien yang lebih tua dengan anemia dan hipoalbuminemia untuk menjaga fungsi kognitif.
Mekanisme inflamasi terlibat dalam perkembangan gangguan kognitif dan demensia. 44 Penelitian telah menunjukkan peningkatan kadar CRP pada individu dengan demensia, 45 dan proses inflamasi dapat mendahului timbulnya gejala klinis hingga 25 tahun. 46 Temuan ini dapat membantu menjelaskan hasil kami, yang menunjukkan bahwa kadar enam neuro-penanda yang diteliti, kecuali Aβ42, berkorelasi dengan CRP dan SAA.
Di antara indikator yang tidak terklasifikasi, D-Dimer adalah produk degradasi fibrin yang berbeda yang terutama mencerminkan fibrinolisis. Kadar D-Dimer yang meningkat menunjukkan keadaan hiperkoagulabilitas dan hiperfibrinolisis sekunder. Penelitian sebelumnya tentang hubungan antara D-Dimer dan biomarker saraf terbatas. Sebuah penelitian yang meneliti kadar NfL serum pada pasien COVID-19 tanpa manifestasi neurologis yang signifikan melaporkan korelasi positif antara D-Dimer plasma dan NfL pada pasien dengan COVID-19 ringan 38 . Temuan kami juga menunjukkan bahwa kadar D-Dimer yang lebih tinggi dikaitkan dengan peningkatan kadar NfL plasma dan p-tau181. Penelitian lebih lanjut diperlukan untuk menjelaskan mekanisme biologisnya.
Singkatnya, riwayat stroke, Hcy, asam folat, Cys-C, CKD-EPI2009scr, Alb, dan Hb semuanya berkorelasi dengan neuro-marker plasma, konsisten dengan temuan dari penyelidikan sebelumnya. 24 , 26 , 36 , 37 , 39 Kami juga mengidentifikasi beberapa indikator yang jarang dibahas, seperti BNP, CRP, SAA, dan D-Dimer, yang juga berkorelasi dengan neuro-marker ini. Hasil-hasil ini menunjukkan bahwa cedera saraf kranial, fungsi jantung dan ginjal, hipoproteinemia, anemia, kadar inflamasi, dan fungsi fibrinolisis dapat, sampai batas tertentu, memengaruhi konsentrasi plasma neuro-marker dan berpotensi memengaruhi perjalanan patologis AD. Namun, penting untuk mengakui sifat kompleks dari interaksi ini ketika menafsirkan korelasi ini. Meskipun gangguan kognitif kemungkinan dipengaruhi oleh indikator serum seperti kadar albumin, Hb, asam folat, dan D-Dimer, gangguan itu sendiri dapat menyebabkan asupan nutrisi penting yang tidak mencukupi, status gizi yang tidak memadai, atau peningkatan risiko pembekuan darah karena aktivitas fisik yang menurun. Penelitian tambahan diperlukan untuk menentukan apakah korelasi ini menunjukkan hubungan kausal atau konsekuensial.
Studi kami menunjukkan potensi penggunaan neuro-marker plasma p-tau 181 dan GFAP untuk membedakan individu dengan AD dari individu non-demensia, dengan kinerja diagnostik yang sebanding dengan literatur yang ada bahkan dalam populasi yang lebih tua dengan berbagai komorbiditas. 13 , 47 Mengingat prevalensi substansial dari gangguan kognitif di antara populasi yang lebih tua, kami memasukkan individu dengan demensia non-AD dalam kelompok non-AD untuk memperluas studi, dengan mempertimbangkan kebutuhan klinis praktis. Kinerja diagnostik penanda plasma saja untuk membedakan antara AD dan non-AD lebih rendah daripada untuk membedakan antara kelompok AD dan non-demensia. Model kami menunjukkan hal ini disebabkan oleh pengaruh berbagai faktor, seperti komorbiditas terkait neuro, nutrisi, dan peradangan pada populasi yang lebih tua. Kami menemukan bahwa Model Sederhana 4, yang menggabungkan BNP, hipertensi, dan MMSE dengan p-tau181, NfL, usia, dan jenis kelamin, mencapai AUC sebesar 0,8470. Spesifisitas untuk mengidentifikasi pasien AD melebihi 90%, yang menunjukkan bahwa model tersebut akan bermanfaat untuk mengurangi tingkat kesalahan diagnosis dan secara akurat menargetkan populasi berisiko tinggi selama pemeriksaan umum. Dalam penelitian kami, p-tau181 menunjukkan akurasi yang konsisten, yang menjadikannya sebagai komponen penting dari model diagnostik kami untuk pasien paruh baya dan tertua. Meskipun terjadi perubahan fisiologis terkait usia dan adanya beberapa penyakit penyerta, p-tau181 terbukti menjadi biomarker yang kuat untuk membedakan AD dari bentuk penurunan kognitif lainnya.
Selain p-tau 181, hipertensi memiliki bobot tertinggi dalam Model Sederhana 3. Hal ini menyoroti pentingnya menggabungkan hipertensi ke dalam model skrining untuk populasi lanjut usia, dan literatur 48 – 50 juga menunjukkan dampak signifikannya dalam meningkatkan risiko AD. Mekanisme yang terlibat termasuk promosi neuro-inflamasi dan eksaserbasi patologi amiloid melalui gangguan BBB. Temuan kami mendukung gagasan bahwa mengintegrasikan hipertensi ke dalam model skrining meningkatkan spesifisitas dan sensitivitas, meningkatkan utilitasnya untuk skrining AD. Manajemen hipertensi dini dan konsisten juga dapat meningkatkan kesehatan kognitif secara keseluruhan dan menunda timbulnya gejala AD. Namun, tidak ada korelasi yang signifikan secara statistik antara hipertensi dan konsentrasi neuro-marker plasma yang dipelajari, yang menunjukkan bahwa jalur fisiologis AD yang terkait dengan hipertensi dan neuro-marker plasma mungkin tidak saling berhubungan.
Kami mengamati korelasi antara BNP dan AD, seperti yang ditunjukkan dalam penelitian sebelumnya. 29 , 30 Namun, korelasi tersebut menunjukkan korelasi yang lemah dengan penanda saraf, seperti yang ditunjukkan pada Gambar 4. Hal ini menunjukkan bahwa penyertaan indikator-indikator ini meningkatkan kinerja skrining AD pada populasi yang lebih tua dengan saling melengkapi dalam model, karena indikator-indikator ini berhubungan dengan patogenesis AD melalui faktor risiko eksternal, indikator neuroinflamasi, dan perspektif patologis.
Model diagnostik kami menyediakan alternatif yang minimal invasif dan mudah diakses untuk standar emas saat ini, seperti pengambilan sampel CSF dan pencitraan PET. Tidak seperti pendekatan tradisional ini, yang sangat invasif atau sangat mahal, model kami dapat dengan mudah diimplementasikan dalam pengaturan klinis dengan beban pasien minimal. Sementara CSF dan PET menawarkan sensitivitas dan spesifisitas yang tinggi, keterbatasan mereka dalam hal invasif dan biaya telah menyebabkan kepatuhan pasien yang rendah, terutama di antara populasi yang lebih tua. Sebaliknya, kami menunjukkan akurasi diagnostik yang menjanjikan dari model kami, yang menunjukkan bahwa pengujian neuro-marker berbasis darah dapat berfungsi sebagai alat skrining yang efektif, terutama bagi individu yang tidak dapat atau tidak mau menjalani prosedur invasif. Ini menyoroti potensi pendekatan kami untuk melengkapi atau bahkan menggantikan alat diagnostik saat ini dalam skenario tertentu, dengan demikian meningkatkan deteksi dan manajemen AD pada populasi yang lebih luas.
5 KETERBATASAN
Pentingnya penggunaan pemeriksaan yang tidak invasif dan mudah diakses ini pada populasi lansia tidak boleh diremehkan. Kekuatan penting dari penelitian ini terletak pada penyertaan populasi yang berkarakteristik baik tanpa pengecualian berdasarkan usia atau kondisi. Pendekatan ini menantang praktik yang berlaku, di mana individu lansia dengan penyakit penyerta sering dikecualikan dari skrining kognitif dan studi diagnostik etiologi diferensial. Namun, penelitian ini memiliki beberapa keterbatasan. (1) Ukuran sampel yang terbatas menimbulkan tantangan signifikan dalam menggeneralisasi temuan kami. Penelitian di masa mendatang dengan populasi yang lebih besar dan lebih beragam diperlukan untuk memvalidasi hasil kami. (2) Prevalensi penyakit penyerta yang tinggi, penurunan fungsi fisik, dan kondisi lain di antara pasien lansia mempersulit analisis. Faktor-faktor ini dapat memengaruhi hasil dan menghalangi kemampuan kami untuk melakukan analisis stratifikasi menyeluruh. (3) Mengingat sifat penelitian ini yang bersifat cross-sectional, diperlukan investigasi tindak lanjut jangka panjang tambahan tentang fluktuasi biomarker dari waktu ke waktu dan korelasinya dengan perkembangan AD. Penelitian semacam itu akan membantu menjelaskan perubahan longitudinal pada penanda protein ini seiring bertambahnya usia dan untuk mengeksplorasi hubungannya dengan ukuran hasil seperti mortalitas. Hal ini akan memperluas kegunaan klinis dari pengukuran ini pada populasi yang lebih tua. (4) Karena kesulitan yang dihadapi individu yang lebih tua dengan pengambilan sampel LCS invasif dan pemindaian PET yang berisiko radiasi, penelitian ini mengandalkan diagnosis klinis untuk mengidentifikasi AD. Tidak adanya data LCS dan PET membatasi analisis komprehensif penanda plasma dalam kaitannya dengan LCS. (5) Mempertimbangkan perbedaan yang signifikan dalam skor MMSE antara kelompok non-AD dan AD, termasuk MMSE dalam model, dapat menimbulkan potensi bias. (6) Penelitian lebih lanjut diperlukan untuk menilai potensi kegunaan penanda protein tambahan, seperti p-tau217, yang telah menunjukkan kinerja yang lebih unggul dalam diagnosis AD dalam literatur Eropa dan Barat lainnya tetapi tidak termasuk dalam penelitian ini. (7) Penelitian ini didasarkan pada populasi Tiongkok tertentu, yang dapat membatasi generalisasi hasil. Penelitian di masa mendatang harus berupaya untuk mereplikasi temuan ini di berbagai populasi untuk memastikan penerapan hasil yang lebih luas.
6 KESIMPULAN
Singkatnya, kami memperluas penyelidikan biomarker AD berbasis darah ke populasi Tionghoa yang lebih tua dengan usia rata-rata 92 tahun, suatu area yang sebelumnya hanya mendapat perhatian penelitian terbatas. Temuan kami menunjukkan bahwa suatu model yang menggabungkan plasma p-tau181, kadar NfL, dan karakteristik klinis spesifik dapat menawarkan potensi diagnostik yang kuat untuk mengidentifikasi AD pada populasi ini. Model ini menyajikan alternatif yang layak untuk mendeteksi AD pada individu yang lebih tua yang tidak mampu atau tidak mau menjalani pungsi lumbal atau pemeriksaan